题目内容
【题目】已知pOH= -lgc(OH-),在T℃下,水溶液中pH与pOH的关系如图中直线所示。下列说法正确的是
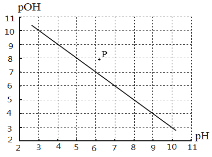
A.T℃下水的离子积为10-14
B.若P点对应的温度为T1,则T1>T
C.T℃,pH=3溶液中,由水电离产生的c(H+)一定为1.0×10-10mol·L-1
D.T℃时,pH=4的盐酸与pOH=4氨水等体积混合后溶液pH>6.5
【答案】D
【解析】
A选项, T℃下,直线中pH= 6时pOH = 7,因此水的离子积为10-13,故A错误;
B选项,若P点对应的温度为T1,P点Kw < 10-13,因此T >T1,故B错误;
C选项,T℃,pH=3溶液,如果是酸溶液,由水电离产生的c(H+)一定为1.0×10-10mol·L-1,如果是水解的盐溶液,由水电离产生的c(H+)一定为1.0×10-3mol·L-1,故C错误;
D选项,T℃时,pH=4的盐酸溶液中c(H+)=10-4mol/L,pOH=4的氨水中c(OH)=10-4mol/L,盐酸属于强酸,氨水为弱碱水溶液,两者等体积混合充分反应后,氨水过量,溶液显碱性,因此pH>6.5,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目