题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol
C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol
写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式________。
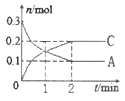
(2)如图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、E2为反应的活化能)。
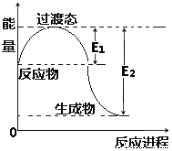
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________、________(填“增大”、“减小”或“不变”);该反应放出的热量为__________kJ。
(3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH____________ 0 (填“大于”、“ 小于”或“大于或小于都可”)。
【答案】3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) △H= + 18.7.4kJ/mol 减小 不变 234 小于
【解析】
(1)FeO与H2O反应的方程式为3FeO+H2O=Fe3O4+H2,①6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s),②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ,根据目标反应方程式,(①+②)/2,得出△H=(-76.0+113.4)/2kJ·mol-1=+18.7kJ·mol-1,热化学反应方程式为 3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) △H= + 18.7.4kJ·mol-1;
(2)使用催化剂,降低活化能,即E1减小,△H只与始态和终态有关,即使用催化剂,△H不变;根据图像该反应放出的热量为(E2-E1)kJ=(368-134)kJ=234kJ;
(3)根据复合判据,能自发进行△G<0,根据反应方程式,该反应为熵减反应,即△S<0,推出△H<0。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)____________________
(2)步骤④中,量取20.00 mL待测液应使用_________________(填仪器名称)
(3)步骤⑤滴定时眼睛应注视______________________________;判断到达滴定终点的依据是:______________________________________。
(4)以下是实验数据记录表
滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.20 |
3 | 20.00 | 0.00 | 16.16 |
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视读数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
(5)根据表中记录数据,通过计算可得,该盐酸浓度为: ____________mol/L
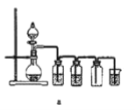
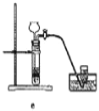
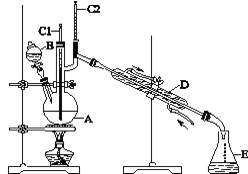
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
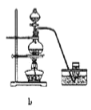
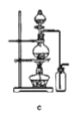
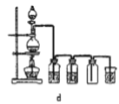
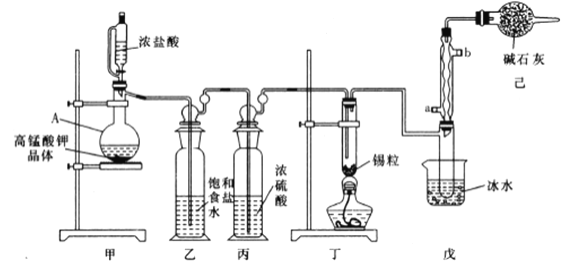
【题目】四氯化锡可用作媒染剂。利用如图装置可以制备四氯化锡(部分夹持装置已略去)。
有关信息如下表:
化学式 |
|
|
摩尔质量( | 190 | 261 |
熔点 | 246 | -33 |
沸点 | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)装置甲中仪器![]() 的名称为_____________。
的名称为_____________。
(2)用装置甲制取氯气,![]() 被还原为
被还原为![]() ,该反应的离子方程式为___________。
,该反应的离子方程式为___________。
(3)将如图装置连接好,先检查装置气密性,再慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热装置丁,锡熔化后适当增大氯气流量,继续加热装置丁,此时继续加热装置丁的目的是:①促进氯气与锡反应;②_________________________。
(4)如果缺少装置乙,可能发生的副反应的化学方程式为_______________;装置己的作用是______(填字母代号)。
A.除去未反应的氯气,防止污染空气
B.防止空气中![]() 气体进入装置戊
气体进入装置戊
C.防止水蒸气进入装置戊的试管中使产物水解
D.防止空气中![]() 进入装置戊的试管中使产物氧化
进入装置戊的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生![]() 杂质,以下试剂中可用于检测是否产生
杂质,以下试剂中可用于检测是否产生![]() 的是______(填字母代号)。
的是______(填字母代号)。
A. ![]() 溶液 B.
溶液 B. ![]() 溶液(滴有
溶液(滴有![]() 溶液) C.
溶液) C. ![]() 溶液
溶液
(6)反应中用去锡粒![]() ,反应后在戊装置的试管中收集到
,反应后在戊装置的试管中收集到![]() ,则
,则![]() 的产率为_____(保留3位有效数字)。
的产率为_____(保留3位有效数字)。