题目内容
【题目】氯碱厂电解饱和食盐水制取氢氧化钠的工艺流程示意图如下:
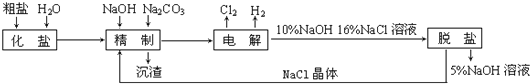
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为_______________________,_______________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和![]() ,相应的化学方程式为______________________。
,相应的化学方程式为______________________。
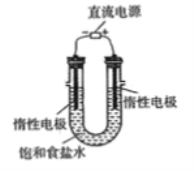
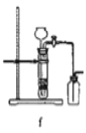
(7)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____________(填“>”、“=”或“<”)2L,原因是_____________________。
(8)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
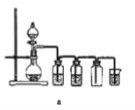
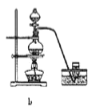
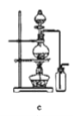
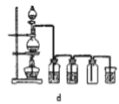
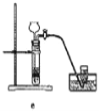
据此,制备并收集干燥、纯净Cl2的装置是______(填代号)。
【答案】2Cl--2e-=Cl2↑ 升高 Ca2++CO32-=CaCO3↓ Mg2++2OH-=Mg(OH)2↓ ac bc 蒸发 过滤 NaCl+H2O ![]() NaClO+H2↑ < 产物氯气会与氢氧化钠反应 d
NaClO+H2↑ < 产物氯气会与氢氧化钠反应 d
【解析】
工业食盐含Ca2+、Mg2+等杂质,由流程可知,粗盐加水化盐溶解后,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液和氯化钠晶体,氯化钠晶体可以用于精制过程,据此分析解答(1)~(7);
(8)利用二氧化锰和浓盐酸加热来获得氯气,制得的氯气中会含有氯化氢和水蒸气,据此分析判断。
(1)与电源正极相连的电极为电解池的阳极,发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,与电源负极相连的电极为电解池的阴极,发生还原反应,电极反应式为H2O+2e-=H2↑+2OH-,,生成了氢氧根离子,溶液的碱性增强,溶液的pH升高,故答案为:2Cl--2e-=Cl2↑;升高;
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中加NaOH除去镁离子,加碳酸钠除去钙离子,发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++OH-=Mg (OH)2↓,故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(3)除去硫酸根离子的同时不能引入新的离子,而氯离子和氢氧根离子原溶液中本身就含有,故钡试剂可以是Ba(OH)2或BaCl2,故答案为:ac;
(4)加入的过量的钡离子可以由碳酸钠除去,故碳酸钠需要在钡试剂之后加入,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,故答案为:bc;
(5)NaOH的溶解度随温度的升高而变大,NaCl的溶解度随温度的升高基本不变,利用溶解度差异可以除去NaCl,步骤一般为蒸发浓缩、冷却结晶、过滤,故答案为:蒸发;过滤;
(6)电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:H2O+2e-=H2↑+2OH-,Cl2与NaOH充分接触,采用无隔膜电解冷的食盐水时,产物仅是NaClO和H2,反应的化学方程式为:NaCl+H2O![]() NaClO+H2↑,故答案为:NaCl+H2O
NaClO+H2↑,故答案为:NaCl+H2O![]() NaClO+H2↑;
NaClO+H2↑;
(7)电解饱和食盐水中若收集的H2为2L,产物 Cl2 会与 NaOH反应,则同样条件下收集的Cl2 <2L,故答案为:<;产物Cl2会与NaOH反应;
(8)实验室利用二氧化锰和浓盐酸加热来获得氯气,属于加热固体和液体生成气体的反应,其中的杂质氯化氢可以加饱和食盐水来除,杂质水蒸气可以采用浓硫酸来除去,故选装置d,故答案为:d。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案