题目内容
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中较稳定,广泛应用于日常生产生活中。向下图所示装置中通入SO2,在加热条件下反应可制得Na2S2O3·5H2O。

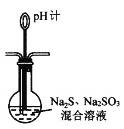
回答下列问题:
(1)S2O32-结构式如图所示,其中S*的化合价为_________。
(2)烧瓶中发生反应的离子方程式为_________________________。
(3)25℃时,当溶液pH接近7时,需立即停止通SO2,原因是____________________。(用离子方程式表示)
(4)反应终止后,经加热浓缩,冷却结晶,过滤、洗涤、干燥等一系列操作可得Na2S2O3·5H2O晶体。其中洗涤剂可选用____________。(填标号)
A.水 B.乙醇 C.稀盐酸 D.氢氧化钠溶液
(5)准确称取1.4g产品,加入刚煮沸并冷却过的水20mL,使其完全溶解,以淀粉作指示剂,用0.1000mol·L-1标准碘水溶液滴定。已知:2S2O32-+I2(aq)=S4O62-(无色)+2I-(aq)。
①标准碘水应盛放在_______(填“酸式”或“碱式”)滴定管中。
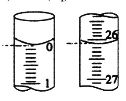
②第一次滴定开始和结束时,滴定管中的液面如下图所示,则第一次消耗碘水标准溶液的体积为_____mL。
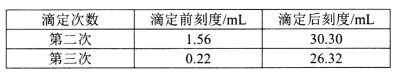
③重复上述操作三次,记录另两次数据如下表,则产品中Na2S2O3·5H2O的质量分数为_______%。(保留1位小数)
【答案】+4 3SO2+2S2-+SO32-![]() 3S2O32- S2O32-+2H+==S↓+SO2↑+H2O B 酸式 26.10 92.5%
3S2O32- S2O32-+2H+==S↓+SO2↑+H2O B 酸式 26.10 92.5%
【解析】
(1)S2O32-中S*与3个O相连,O的电负性大于S;
(2)二氧化硫、硫化钠和亚硫酸钠反应生成硫代硫酸钠;
(3)若溶液呈酸性,硫代硫酸根离子可与氢离子反应生成二氧化硫气体、硫沉淀和水;
(4)硫代硫酸钠晶体易溶于水,难溶于乙醇,为减少硫代硫酸钠的溶解,选用乙醇洗涤除杂,还可加速干燥;
(5)①碘水中少量的碘与水反应生成氢碘酸和次碘酸,溶液呈酸性;
②初始读数为0mL,结束时读数为26.10mL,则第一次碘水的体积为26.10mL;
③第二次体积为28.74mL,第三次体积为26.10mL,第二次数据明显偏大,舍弃不用,再利用方程式计算。
(1)S2O32-中S*与3个O相连,O的电负性大于S,则其化合价为+4价;
(2)二氧化硫、硫化钠和亚硫酸钠反应生成硫代硫酸钠,离子方程式为3SO2+2S2-+SO32-![]() 3S2O32-;
3S2O32-;
(3)若溶液呈酸性,硫代硫酸根离子可与氢离子反应生成二氧化硫气体、硫沉淀和水,离子方程式为S2O32-+2H+==S↓+SO2↑+H2O;
(4)硫代硫酸钠晶体易溶于水,难溶于乙醇,为减少硫代硫酸钠的溶解,选用乙醇洗涤除杂,还可加速干燥,答案为B;
(5)①碘水中少量的碘与水反应生成氢碘酸和次碘酸,溶液呈酸性,则用酸式滴定管盛放;
②初始读数为0mL,结束时读数为26.10mL,则第一次碘水的体积为26.10mL;
③第二次体积为28.74mL,第三次体积为26.10mL,第二次数据明显偏大,舍弃不用,平均体积为26.10mL,2S2O32-~I2,n(S2O32-)=0.1000mol·L-1×26.10mL×2=0.00522mol,质量分数=![]() ×100%=92.5%。
×100%=92.5%。

 名校课堂系列答案
名校课堂系列答案