题目内容
2.下列叙述正确的是( )| A. | 硫酸钡的水溶液几乎不导电,所以硫酸钡是弱电解质 | |
| B. | 二氧化硫和二氧化氮的水溶液都能导电,所以二者都是电解质 | |
| C. | 氨气的水溶液可以导电,所以氨是电解质 | |
| D. | 氢氧化钙在水中的溶解度很小,但它溶解的部分完全电离,所以氢氧化钙是强电解质 |
分析 A.硫酸钡是难溶的盐,熔融状态完全电离;
B.二氧化硫的水溶液中能电离出阴阳离子的是亚硫酸而不是二氧化硫,二氧化氮与水反应生成硝酸是硝酸电离产生电离产生氢离子与硝酸根离子;
C.氨气不能电离出离子;
D.强弱电解质与溶解度大小没有必然关系,氢氧化钙溶于水的部分完全电离,所以氢氧化钙属于强电解质.
解答 解:A.强电解质是在水溶液中或熔融状态下能完全电离的电解质,硫酸钡是难溶的盐,投入水中,导电性较弱,但熔融状态完全电离,所以BaSO4是强电解质,故A错误;
B.二氧化硫的水溶液中能电离出阴阳离子的是亚硫酸而不是二氧化硫,二氧化氮与水反应生成硝酸是硝酸电离产生电离产生氢离子与硝酸根离子,而不是二氧化氮本身电离产生的离子,故B错误;
C.氨气的水溶液导电,导电的离子是一水合氨电离的,不是氨气本身电离的,所以氨气为非电解质,故C错误;
D.强弱电解质与溶解度大小没有必然关系,关键看电解质能否完全电离,氢氧化钙溶于水的部分完全电离,所以氢氧化钙为强电解质,故D正确;
故选D.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断、溶液导电性强弱判断,题目难度中等,注意明确电解质与非电解质、强电解质与弱电解质的概念及根本区别,明确影响溶液导电性的根本因素、导电性与强弱电解质没有必然关系.

练习册系列答案
相关题目
12.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②③⑤ | C. | ⑤ | D. | ④⑥ |
10.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | C2H4 CH4 | B. | CO2 H2S | C. | C60 C2H4 | D. | NH3 HCl |
17.某有机物的结构简式如下所示,该有机物可能具有的性质是( )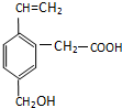
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.

①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.
| A. | 只有②③④ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有②④ |
7.合成结构简式为 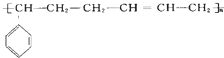 的高聚物,其单体应是( )
的高聚物,其单体应是( )
①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯.
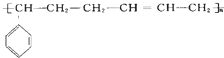 的高聚物,其单体应是( )
的高聚物,其单体应是( )①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ② | B. | ④⑤ | C. | ①③ | D. | ③⑤ |
14.下列关于如图所示原电池装置的叙述中,正确的是( )
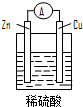

| A. | 铜片是负极 | B. | 铜片表面反应为:Cu-2e- Cu2+ | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
11.下列叙述中正确的是( )
| A. | 不慎把苯酚沾到了皮肤上,应立即用酒精洗涤,再用水冲洗 | |
| B. | 配制银氨溶液时,将稀氨水滴加到硝酸银溶液中,至产生的沉淀溶解为止 | |
| C. | 淀粉水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 | |
| D. | 在苯和液溴的混合物中加少量铁粉即可得到溴苯 | |
| E. | 向溴乙烷跟烧碱反应后的混合液中滴加硝酸银溶液,可以检验水解生成的溴离子 | |
| F. | 实验室进行石油的蒸馏、乙酸乙酯的水解、中和反应反应热的测定实验时均需要使用温度计 |
12.其它条件不变,升高温度下列数据不一定增大的是( )
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
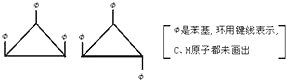 1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )
1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )