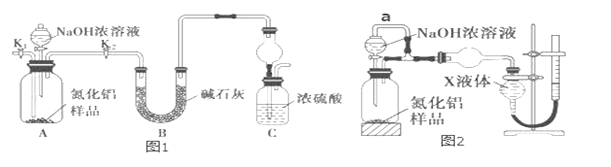
题目内容
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
【答案】D
【解析】
盐酸为一元强酸,醋酸为一元弱酸,常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液中,氢离子浓度比较:盐酸大于醋酸,据此分析作答。
A. 盐酸为一元强酸,完全电离,其离子方程式为:HCl=H++Cl-,而醋酸为一元弱酸,部分电离,其离子方程式为:CH3COOH![]() CH3COO-+H+,则常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液中的c(CH3COOˉ)< c(Clˉ),A项错误;
CH3COO-+H+,则常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液中的c(CH3COOˉ)< c(Clˉ),A项错误;
B. 等浓度的醋酸电离出的氢离子浓度小于盐酸的,则溶液的pH比较:CH3COOH> HCl,B项错误;
C. 醋酸为一元弱酸,发生部分电离,其离子方程式为:CH3COOH![]() CH3COO-+H+,C项错误;
CH3COO-+H+,C项错误;
D. 盐酸为一元强酸,则等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液溶质为氯化钠,呈中性,D项正确;
答案选D。

 阅读快车系列答案
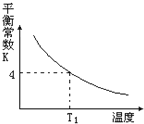
阅读快车系列答案【题目】T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)![]() 3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
Y | 2 | 1.60 |
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 2ΔH’=ΔH
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2