题目内容
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
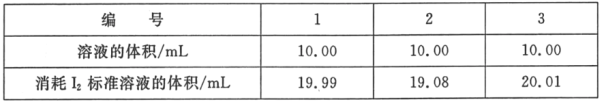
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
【答案】S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O 当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化 偏低 从表格中可以看出,第二次滴定误差较大,不应计算在平均值里面,消耗I2标准溶液的平均值为20.00mL。由2S2O32﹣+I2═S4O62﹣+2I﹣,可知5.5g样品中n(Na2S2O35H2O)=n(S2O32﹣)=2n(I2)=2×0.02L×0.05mol/L×![]() =0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为
=0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为![]() ×100%=90.18%,故答案为:90.18%。
×100%=90.18%,故答案为:90.18%。
【解析】
(1)碱性条件下二者发生氧化还原反应生成氯离子和硫酸根离子;(2)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为溶液变蓝色且半分钟内不褪色;依据反应的定量关系2S2O32﹣+I2=S4O62﹣+2I﹣计算碘单质消耗的硫代硫酸钠,计算得到样品中的质量分数。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,反应的离子方程式为S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O,故答案为:S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O;
(2)①加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变,说明Na2S2O3反应完毕,滴定到达终点,故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则Na2S2O3反应不完全,导致测定结果偏低,故答案为:偏低;
③第2次实验消耗标准液的体积与其它2次相差比较大,应舍弃,1、3次实验的标准液平均值为消耗标准液体积,即消耗标准液体积为20mL,由2S2O32﹣+I2═S4O62﹣+2I﹣,可知5.5g样品中n(Na2S2O35H2O)=n(S2O32﹣)=2n(I2)=2×0.02L×0.05mol/L×![]() =0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为
=0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为![]() ×100%=90.18%,故答案为:90.18%。
×100%=90.18%,故答案为:90.18%。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
