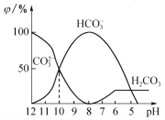
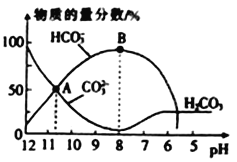
题目内容
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
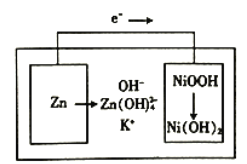
A. 放电时溶液中的K+移向负极 B. 充电时阴极附迁的pH会降低
C. 理论上负极质量每减少6.5g,溶液质量增加6.3g D. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
【答案】C
【解析】A、根据原电池的工作原理,阳离子向正极移动,即K+放电时向正极移动,故A错误;B、根据电池的工作原理,电子从Zn流向另一极,即Zn为负极,负极反应式为Zn-2e-+4OH-=Zn(OH)42-,充电时,电池的负极接电源的负极,即充电时的电极反应式应是放电的逆过程,Zn(OH)42-+2e-=Zn+4OH-,阴极区pH增大,故B错误;C、负极反应式为Zn-2e-+4OH-=Zn(OH)42-,正极反应式:NiOOH+H2O+e-=Ni(OH)2+OH-,负极消耗6.5g锌,转移电子物质的量为6.5×2/65mol=0.2mol,溶液质量增加6.5g,正极上溶液减轻的H+,即通过0.2mol电子时,正极减轻质量为0.2×1g=0.3g,因此整个溶液质量增加(6.5-0.2)g=6.3g,故C正确;D、根据上述分析,锌作负极,则另一极为正极,正极上得到电子,化合价降低,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】I、有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:
(1)能使石蕊试液变色的有______种.
(2)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是______
(3)不同情况下与氢氧化钠反应能生成两种盐的是______.
II、有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为:________. |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________. |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况). | (3)用结构简式表示A中含有的官能团:________、________. |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子. |
(5)综上所述,A的结构简式________. | |