题目内容
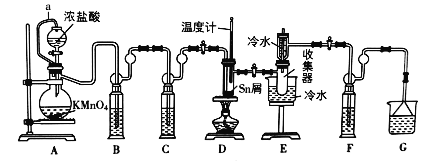
【题目】无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,实验室可用熔融的锡(熔点231℃)与Cl2反应制备SnCl4,装置如图所示,请回答下列问题:
已知,SnCl4在潮湿的空气中极易水解生成SnO2xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)导管a的作用是______,装置A中发生反应的化学方程式为______。
(2)装置B、C、F、G中盛放的最佳试剂依次为______(填序号,试剂可重复使用),
①饱和Na2CO3溶液②NaOH溶液③浓H2SO4④饱和NaCl溶液⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______。
(4)若撤去装置C,则D中发生的主要副反应化学方程式为______。
(5)得到的产物中常含有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取该样品mg放入锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1molL-1碘标准溶液滴定至终点时锥形瓶内溶液颜色变化是______,若消耗标准液20.00mL,则产品中SnCl4的质量含量为______(用含m的代数式表示)
【答案】使装置中A中分液漏斗内的液体顺利流下 2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2+8H2O ④③③② 打开装置A中分液漏斗活塞,使整套装置中充满黄绿色气体Cl2 SnCl4+(x+2)H2O=SnO2xH2O+4HCl 当最后一滴碘标准溶液时,锥形瓶中溶液由无色变为蓝色,且半分钟内不褪色 ![]()
【解析】
(1)导管a的作用是使分液漏斗内的液体顺利流下;实验采用KMnO4和浓盐酸反应的方法制取Cl2,据此写出反应的化学方程式;
(2)由于盐酸易挥发,制备的氯气中含有HCl气体,用饱和食盐水除去HCl,再用浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在D中反应生成SnCl4,经冷却后在装置G中收集,防止SnCl4吸收水分而潮解,用浓硫酸隔离,未反应的氯气,用氢氧化钠溶液吸收,防止污染空气;
(3)因金属锡易与氯气、氧气反应,反应时应先生成氯气,将氧气排出;
(4)SnC14和H2O反应生成SnO2xH2O和HCl据此书写化学反应方程式;
(5)由于Sn2++I2=Sn4++2I-,所以开始滴定时溶液无色,终点时I2略过量,淀粉变蓝;根据Sn2++I2═Sn4++2I-,n(SnCl2)=n(I2)据此计算产品中SnCl2的含量,进而计算出SnCl4的含量。
(1)导管a的作用是平衡大气压,使装置中A中分液漏斗内的液体顺利流下,装置A中用高锰酸钾与浓盐酸反应制备氯气,故发生反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2+8H2O。
(2)由于盐酸易挥发,制备的氯气中含有HCl,用B装置盛装的饱和食盐水除去HCl,再用C装置中的浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在D中反应生成SnCl4,经冷却后在装置G中收集,防止SnCl4吸收水分而潮解,用浓硫酸隔离,未反应的氯气,用G中氢氧化钠溶液吸收,防止污染空气;
故答案为:④③③②;
(3)点燃酒精灯前需要进行的一步操作是打开装置A中分液漏斗活塞,使整套装置中充满黄绿色气体Cl2,排出装置中的空气,防止Sn在加热时被空气中氧气氧化。
(4)若撤去装置C,氯气中含有水蒸气,则装置D中发生的主要副反应化学方程式为SnCl4+(x+2)H2O=SnO2xH2O+4HCl。
(5)滴定过程中发生反应Sn2++I2=Sn4++2I-,淀粉溶液作指示剂,用0.1molL-1碘标准溶液滴定至终点时锥形瓶内溶液颜色变化是当最后一滴碘标准溶液时,锥形瓶中溶液由无色变为蓝色,且半分钟内不褪色,若消耗标准液20.00mL,则产品中SnCl4的质量含量为![]() ×100%=
×100%=![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下列实验现象及所得结论均正确的是( )
实验 | 实验现象 | 结论 |
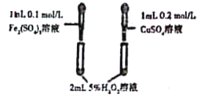
A. | 左侧试管比右侧试管中产生气泡的速率快 | Fe3+对H2O2分解的催化效果更好 |
B. | 左侧棉花变为橙色,右侧棉花变为蓝色 | 氧化性:Cl2>Br2> I2 |
C. | U形管左端液面下降,右端液面上升 | NH4NO3溶解吸热 |
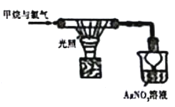
D. | 烧杯中产生白色沉淀 | 甲烷与氯气光照条件下发生取代反应 |
A.AB.BC.CD.D