题目内容
【题目】25 ℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23mol·L-1
C. 除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D. 向饱和FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,Ksp(FeS)变大
【答案】C
【解析】
A、因为Ksp(CuS)=1.3×10-36< Ksp(ZnS)=1.6×10-24< Ksp(FeS)=6.3×10-18,所以溶解度CuS <ZnS<FeS,故A错误;
B、原硫化钠溶液中硫离子增大浓度为:c(S2-)=0.1 mol·L-1,所以锌离子最小浓度为:c(Zn2+)=![]() mol/L=1.6
mol/L=1.6![]() 10-23mol/L,故B错误;
10-23mol/L,故B错误;
C、因为Ksp(CuS)=1.3×10-36< Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂,所以C选项是正确的;
D、向饱和的FeS 溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,温度不变,所以Ksp(FeS)不变,故D错误。
故答案选C。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
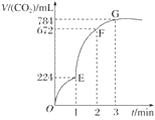
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:

(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
【题目】下列编号代表元素周期表中的一部分元素,用化学式或元素符号回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ⑥ | ⑩ | ||||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ | ⑧ |
(1)①、③、⑤的最高价氧化物的水化物碱性最强的是_______(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)①和⑧的最高价氧化物对应的水化物化学式为________和________。①和⑧两元素形成的化合物的化学式为________,该化合物的溶液与元素⑦的单质反应的离子方程式为_______________________。
(4)⑦、⑧、⑩三种元素形成的气态氢化物最稳定的是________(填化学式,下同),三种元素非金属性由强到弱的顺序为________。
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
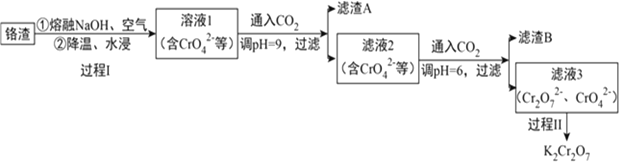
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质可以循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。下表是不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 373 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:向滤液③中加入稀盐酸和KCl固体后,_____________,过滤,得到K2Cr2O7粗品。
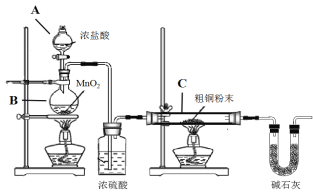
【题目】无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,实验室可用熔融的锡(熔点231℃)与Cl2反应制备SnCl4,装置如图所示,请回答下列问题:
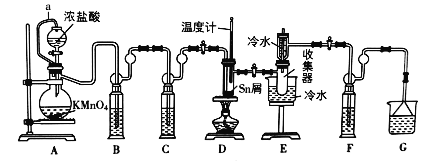
已知,SnCl4在潮湿的空气中极易水解生成SnO2xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)导管a的作用是______,装置A中发生反应的化学方程式为______。
(2)装置B、C、F、G中盛放的最佳试剂依次为______(填序号,试剂可重复使用),
①饱和Na2CO3溶液②NaOH溶液③浓H2SO4④饱和NaCl溶液⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______。
(4)若撤去装置C,则D中发生的主要副反应化学方程式为______。
(5)得到的产物中常含有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取该样品mg放入锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1molL-1碘标准溶液滴定至终点时锥形瓶内溶液颜色变化是______,若消耗标准液20.00mL,则产品中SnCl4的质量含量为______(用含m的代数式表示)