题目内容
【题目】(1)H2S的标准燃烧热ΔH=-akJmol1,H2S燃烧反应的热化学方程式为______
(2)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在催化剂Cu/ZnO存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2
已知:①CO和H2的燃烧热分别为283.0kJ·mol-1和285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
反应Ⅱ的ΔH2=________kJ·mol-1。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其负极材料为_____,正极电极反应式为________。
【答案】2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-2akJ·mol-1 +41.2 Cu O2+4e-+4H+=2H2O
【解析】
(1)燃烧热是1mol物质完全燃烧产生稳定氧化物时放出的热量,硫化氢完全燃烧产生的稳定氧化物为二氧化硫气体和液态水,其燃烧的热化学方程式为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-2akJ·mol-1,
故答案为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-2akJ·mol-1;
(2)由已知CO和H2的燃烧热分别为283.0kJ·mol-1和285.8kJ·mol-1,结合燃烧热定义可得以下热化学方程式:![]() III;
III;![]() IV;
IV;
H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1 V;
根据盖斯定律可知反应CO2(g)+H2(g)=CO(g)+H2O(g)可由 IV-III+V得到,则ΔH2=ΔH5-ΔH4+ΔH3=(-285.8kJ·mol-1)-(- 283.0kJ·mol-1)+(+44.0kJ·mol-1)= +41.2 kJ·mol-1,故答案为:+41.2;
(3)由原电池的反应原理可知,该反应2Cu+O2+2H2SO4=2CuSO4+2H2O,铜失电子被氧化应做负极,正极是比铜不活泼的金属或者石墨,由总反应可知正极是氧气得电子转变成水的反应,电极反应式为:O2+4e-+4H+=2H2O,
故答案为:Cu;O2+4e-+4H+=2H2O;

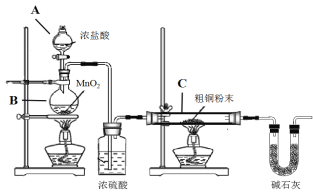
【题目】无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,实验室可用熔融的锡(熔点231℃)与Cl2反应制备SnCl4,装置如图所示,请回答下列问题:
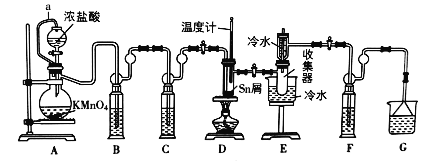
已知,SnCl4在潮湿的空气中极易水解生成SnO2xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)导管a的作用是______,装置A中发生反应的化学方程式为______。
(2)装置B、C、F、G中盛放的最佳试剂依次为______(填序号,试剂可重复使用),
①饱和Na2CO3溶液②NaOH溶液③浓H2SO4④饱和NaCl溶液⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______。
(4)若撤去装置C,则D中发生的主要副反应化学方程式为______。
(5)得到的产物中常含有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取该样品mg放入锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1molL-1碘标准溶液滴定至终点时锥形瓶内溶液颜色变化是______,若消耗标准液20.00mL,则产品中SnCl4的质量含量为______(用含m的代数式表示)