题目内容
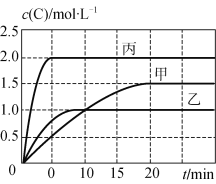
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%
【答案】C
【解析】
试题A、由图可知,10min内甲容器中C的浓度变化量为1mol/L,v(C)=1mol/L÷10min=0.1mol/(Lmin)。由于速率之比等于化学计量数之比,所以v(A)=0.1mol/(Lmin)÷2=0.05mol/(Lmin),A错误;B、比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,故正反应为放热反应,B错误;C、乙中平衡时C的浓度是1.0mol/L,则根据方程式可知,消耗A的浓度是0.5mol/L,物质的量是0.5mol/L×0.5L=0.25mol,所以A的转化率为![]() =
=![]() ;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为
;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为![]() =
=![]() A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,C正确;D、
A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,C正确;D、
A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 3 1 0
转化浓度(mol/L) 0.75 0.75 1.5
平衡浓度(mol/L) 2.25 0.25 1.5
故T1℃,该反应的平衡常数为K=![]() =4
=4
令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,则
A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) x x 2x
平衡浓度(mol/L) 1-x 3-x 2x
所以![]() =4
=4
解得x=0.75
所以故A的转化率=![]() ×100%=75%,D不正确,答案选C。
×100%=75%,D不正确,答案选C。

【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
【题目】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是________,烧杯间填满碎泡沫塑料的作用是_____________。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大” “偏小”或“无影响”)。则中和热ΔH=________(取小数点后一位)。