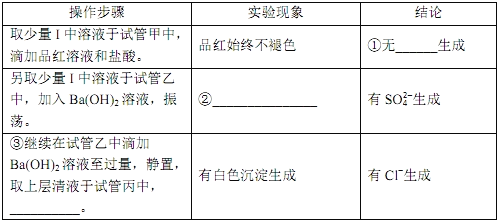
题目内容
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
【答案】C
【解析】
离子共存要根据离子间是否发生复分解反应、氧化还原反应、双水解、络合反应来综合判断。
A. Cu2+、Mg2+与OH-反应生成沉淀,不能大量共存,A错误;
B. Ag+与Cl-反应生成氯化银白色沉淀,不能大量共存,A错误;
C. Na+、K+、SO42-、Cl-之间不发生离子反应,可以大量共存,C正确;
D. Ba2+与CO32-反应生成沉淀,H+与CO32-反应生成气体和水,不能大量共存,D错误。
答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】钢铁行业是工业生产的重要支柱。
(1)已知高炉炼铁的主要反应为:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 kJ·mol-1
写出FeO(s)被CO还原生成Fe(s)和CO2的热化学方程式:________________。
(2)恒温恒容条件下进行反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
2Fe(s)+3CO2(g),下列各项能说明该反应已达到平衡状态的是_______(填写序号字母)。
a.v(CO)正=v(CO2)逆 b.CO、CO2 的浓度之比为1:1
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)ToC时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
2Fe(s)+3CO2(g)的平衡常数为K=27。在1L的密闭容器中分别按下表所示加入物质,维持ToC反应一段时间达到平衡,甲、乙容器中CO的平衡转化率之比=_________。
Fe2O3 | CO | Fe | CO2 | |
甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
(4)下列为合成甲醇的有关化学方程式:
①2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
②H2(g)+CO2(g) ![]() H2O(g)+CO(g)
H2O(g)+CO(g)
③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为_______。
(5)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)2+2Fe(OH)3+4KOH![]() 3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
3Zn+2K2FeO4+8H2O,则充电时的阳极反应式为__________。
(6)炼铁尾气中含有CO,经过回收可用于合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
CH3OH(g) △H=-90.1 kJ·mol-1。ToC,该反应的Kp=6.0×10-3kPa-2(用平衡分压代替平衡浓度所得平衡常数,分压= 总压×物质的量分数)。该温度下的某容器中,若起始充入2molH2、1molCO,平衡时甲醇的平衡分压p(CH3OH)=24.0kPa,则平衡时混合气体中CH3OH的体积分数约为________(用百分数表示,小数点后保留1位)。
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
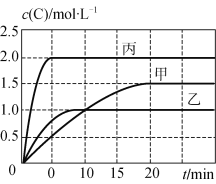
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%