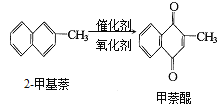
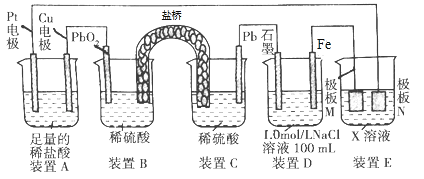
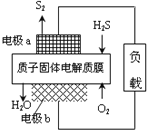
题目内容
【题目】Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
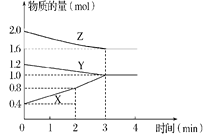
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- +SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
【答案】2Z +Y3X 0.1 molL-1min-1 C 液态或固态 ① SO32-
【解析】
Ⅰ.(1)由图象可知X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比等于它们的物质的量变化之比为0.6:0.2:0.4=3:1:2,所以方程式为2Z +Y3X;
(2)v(X)=![]() =0.1 molL-1min-1;
=0.1 molL-1min-1;
(3)根据图中信息可知,反应开始时各物质的量均不为0,故该反应由正、逆反应同时开始,答案选C;
(4)因固体或纯液体的浓度为常数,改变其用量反应速率不变,故其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为液态或固态;
Ⅱ.(1)由慢反应决定整个反应过程的速率,故反应速率由①步反应决定,故答案为:①;
(2)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变蓝的现象产生。

【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
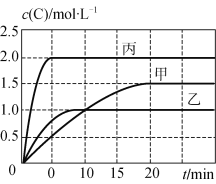
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%