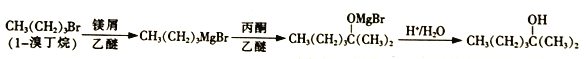题目内容
【题目】某些化学键的键能如下表所示(单位kJ·mol-1):
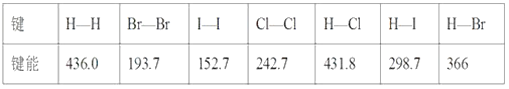
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是________。
A.Cl2>Br2>I2 B.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在足量Cl2中燃烧放热________________(填“多”或“少”)。
【答案】 184.9 A 多
【解析】试题分析:本题考查键能与化学反应中的能量变化的关系。
(1)H2与Cl2的反应为H2+Cl2=2HCl,断裂1molH-H键和1molCl-Cl键吸收能量为(436.0+242.7)kJ=678.7kJ,形成2molH-Cl键释放能量为2![]() 431.8kJ=863.6kJ,1molH2和1molCl2完全反应生成2molHCl放出的热量为(863.6-678.7)kJ=184.9kJ;1molH2在2molCl2中燃烧,参加反应的H2和Cl2都是1mol,放出的热量为184.9kJ。
431.8kJ=863.6kJ,1molH2和1molCl2完全反应生成2molHCl放出的热量为(863.6-678.7)kJ=184.9kJ;1molH2在2molCl2中燃烧,参加反应的H2和Cl2都是1mol,放出的热量为184.9kJ。
(2)H2与Br2的反应为H2+Br2=2HBr,断裂1molH-H键和1molBr-Br键吸收能量为(436.0+193.7)kJ=629.7kJ,形成2molH-Br键释放能量为2![]() 366kJ=732kJ,1molH2与足量Br2反应,放出的热量为(732-629.7)kJ=102.3kJ。H2与I2的反应为H2+I2=2HI,断裂1molH-H键和1molI-I键吸收能量为(436.0+152.7)kJ=588.7kJ,形成2molH-I键释放能量为2
366kJ=732kJ,1molH2与足量Br2反应,放出的热量为(732-629.7)kJ=102.3kJ。H2与I2的反应为H2+I2=2HI,断裂1molH-H键和1molI-I键吸收能量为(436.0+152.7)kJ=588.7kJ,形成2molH-I键释放能量为2![]() 298.7kJ=597.4kJ,1molH2与足量I2反应,放出的热量为(597.4-588.7)kJ=8.7kJ。根据上述计算,1molH2与足量Cl2、Br2、I2分别反应,放出热量由多到少的是Cl2
298.7kJ=597.4kJ,1molH2与足量I2反应,放出的热量为(597.4-588.7)kJ=8.7kJ。根据上述计算,1molH2与足量Cl2、Br2、I2分别反应,放出热量由多到少的是Cl2![]() Br2
Br2![]() I2,答案选A。由于H-F键的键能大于H-Cl键的键能,HF比HCl稳定,结合上述计算的结论,预测1molH2在足量F2中燃烧比在足量Cl2中燃烧放热多。
I2,答案选A。由于H-F键的键能大于H-Cl键的键能,HF比HCl稳定,结合上述计算的结论,预测1molH2在足量F2中燃烧比在足量Cl2中燃烧放热多。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案