题目内容
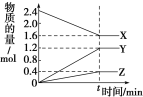
【题目】已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A 为红棕色气体,B为强酸,X为常见金属单质。

(1) C的化学式为____________。
(2) A与水反应的化学方程式为____________。
(3)某温度下(>100℃)若mgX与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式___________。
【答案】 Fe (NO3)3 3NO2+H2O=2HNO3+NO 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H=-168Q/m kJ/mol
【解析】试题分析:常温下A 为红棕色气体,则A是NO2,B为强酸,B是硝酸,E是NO;X为常见金属单质,根据流程图,X为变价金属,X是铁;C是硝酸铁;D是硝酸亚铁。
解析:根据以上分析,(1) C是硝酸铁,化学式为Fe (NO3)3;
(2)NO2与水反应生成硝酸和NO 的化学方程式为3NO2+H2O=2HNO3+NO。
(3)铁与水蒸气反应生成Fe3O4和H2,若mgX与H2O反应放出QkJ(Q>0)的热量,则3mol铁反应放出热量168Q/m kJ。该反应的热化学方程式为3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H=-168Q/m kJ/mol。

练习册系列答案
相关题目