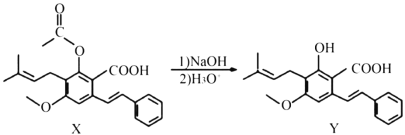
题目内容
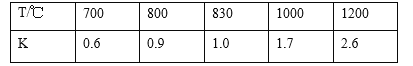
【题目】在一定体积的密闭容器中进行化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示
请回答下列问题:
(1)该反应的正反应为______(填“吸热”或“放热”)反应,
(2)某温度下,在2L的密闭容器中,加入 1molCO2和 1mol H2,充分反应达平衡时,CO的平衡浓度为0.25mol/L,试判断此时的反应温度为________
(3)若在(2)所处的温度下,在1L的密闭容器中,加入2moCO2和3 mol H2,则充分反应达平衡时,H2的物质的量______
A.等于1.0mol B.大于1.0mol
C.大于0.5mol,小于1.0mol D.无法确定
【答案】吸热 830 B
【解析】
(1)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,温度升高平衡向吸热反应移动;
(2)计算平衡时各物质的量的浓度,再根据k=c(CO)·c(H2O)/c(CO2)·c(H2)计算平衡常数判断温度;
(3)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
再根据平衡常数k=c(CO)·c(H2O)/c(CO2)·c(H2)=1列方程计算解答.
(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应;
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol·L-1,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始浓度(mol):0.5 0.5 0 0
变化浓度(mol):0.25 0.25 0.25 0.25
平衡浓度(mol):0.25 0.25 0.25 0.25
平衡常数K=![]() =1,
=1,
故所处温度为830℃;
令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol):2 3 0 0
变化(mol):y y y y
平衡(mol):2-y 3-y y y
再根据平衡常数k=c(CO)·c(H2O)/c(CO2)·c(H2)=1
则平衡常数K=![]() =1,解得y=1.2,故平衡时H2的物质的量为3mol-1.2mol=1.8mol。
=1,解得y=1.2,故平衡时H2的物质的量为3mol-1.2mol=1.8mol。
故选B。