题目内容
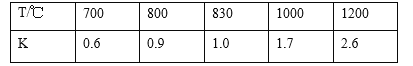
【题目】浓硫酸和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
CO2↑+2H2O+2SO2↑。用如图所示装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。

(1)这些装置的连接顺序(按产物气流从左到右的方向)是____→___→____→____。(填装置的序号)
(2)装置②中要检验产物中有水蒸气,则放入的药品是______;装置③中要检验产物中有二氧化碳气体,则放入的药品是___________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_______,B瓶溶液的作用是_________,C瓶溶液的作用是______________。
【答案】④ ② ① ③ 无水硫酸铜粉末 澄清石灰水 检验二氧化硫的存在 除去气体中的SO2 证明SO2气体已完全除尽
【解析】
(1)验证浓硫酸与木炭粉在加热条件下反应产生的各种产物时,先验证水,再验证SO2,最后验证CO2,据此分析;
(2)该实验中用无水CuSO4检验H2O,品红溶液用于检验SO2,用澄清石灰水检验CO2;为防止SO2对CO2的检验造成干扰,在检验CO2前除尽SO2,据此分析;
(1)验证浓硫酸与木炭粉在加热条件下反应产生的各种产物时,先验证水,再验证SO2,最后验证CO2,
故答案为:④;②;①;③;
(2)该实验中用无水CuSO4检验H2O,品红溶液用于检验SO2,用澄清石灰水检验CO2;实验时可观察到装置①的A瓶的溶液褪色,C瓶的溶液不褪色,是因为为防止SO2对CO2的检验造成干扰,在检验CO2前除尽SO2,故A瓶溶液用于检验二氧化硫的存在,B瓶溶液的用于除去气体中的SO2,C瓶中品红溶液用于检验SO2是否除尽。
故答案为:无水硫酸铜粉末;澄清石灰水;检验二氧化硫的存在;除去气体中的SO2;证明SO2气体已完全除尽。

【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
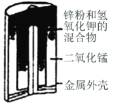
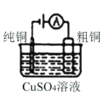
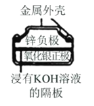
图I碱性锌锰电池 | 图II铅-硫酸蓄电池 | 图III电解精炼铜 | 图IV银锌纽扣电池 |
A.图Ⅰ所示电池中,正极的电极反应式为Zn-2e+2OH-=Zn(OH)2
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极沿导线流向Ag2O极