题目内容
【题目】锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中氢离子浓度为0.1 mol·L-1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol 硫酸B.气体甲中二氧化硫与氢气的体积比为4∶1
C.反应中共消耗97.5 g 锌D.反应中共转移3 mol电子
【答案】B
【解析】
Zn和浓硫酸先反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行硫酸浓度降低,发生Zn+H2SO4=ZnSO4+H2↑,然后在具体分析;
A. Zn和浓硫酸先反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行硫酸浓度降低,发生Zn+H2SO4=ZnSO4+H2↑,反应后溶液稀释至1L,测的溶液中c(H+)=0.1mol·L-1,说明硫酸过量,剩余硫酸的物质的量为 ![]() ×1L×0.1mol·L-1=0.05mol,总硫酸物质的量为100×10-3L×18.5mol·L-1=1.85mol,即反应过程中消耗硫酸的物质的量为(1.85mol-0.05mol)=1.8mol,故A说法正确;
×1L×0.1mol·L-1=0.05mol,总硫酸物质的量为100×10-3L×18.5mol·L-1=1.85mol,即反应过程中消耗硫酸的物质的量为(1.85mol-0.05mol)=1.8mol,故A说法正确;
B. 令生成amolSO2和bmolH2,则有:![]()
![]() 得到2a+b=1.8mol,反应后得到气体物质的量为(a+b)mol=
得到2a+b=1.8mol,反应后得到气体物质的量为(a+b)mol=![]() ,联立解得a=0.3,b=1.2,即相同条件下,气体体积之比等于物质的量之比,SO2和H2的体积之比为0.3:1.2=1:4,故B说法错误;
,联立解得a=0.3,b=1.2,即相同条件下,气体体积之比等于物质的量之比,SO2和H2的体积之比为0.3:1.2=1:4,故B说法错误;
C. 根据选项A的分析,反应后溶液中的溶质为H2SO4和ZnSO4,根据硫酸守恒得出n(H2SO4)+n(ZnSO4)+n(SO2)=n(H2SO4)总,得出n(ZnSO4)=(1.85mol-0.05mol-0.3mol)=1.5mol,消耗Zn的质量为1.5mol×65g·mol-1=97.5g,故C说法正确;
D. 整个反应中Zn失电子,反应中转移电子物质的量为1.5mol×2=3mol,故D说法正确;
故答案为:B。

 综合自测系列答案
综合自测系列答案【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是( )
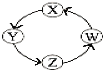
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(OH)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D

