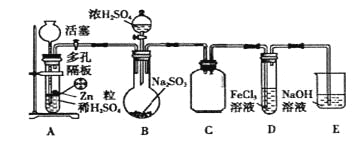
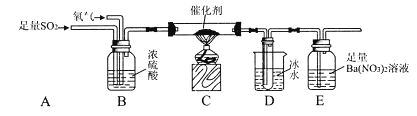
��Ŀ����
����Ŀ��һ���¶��£���1L�ܱ������м���1.0molX��������Ӧ��![]()
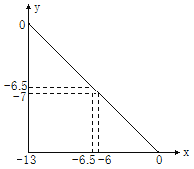
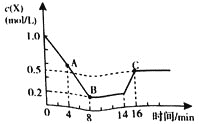
![]() ����14minʱ�����¶ȣ�X�����ʵ���Ũ�ȱ仯��ͼ��ʾ������˵����ȷ����
����14minʱ�����¶ȣ�X�����ʵ���Ũ�ȱ仯��ͼ��ʾ������˵����ȷ����
A.4minʱ������<����
B.8min��16minʱ��Ӧ������ƽ��״̬������������µ�����Ӧ�������
C.��Ӧ��8minʱ����Ӧ����200kJ����
D.�����������䣬����Ӧ�ھ��Ⱥ��������н��У���ѹǿ����ʱ��Ӧ�ʹ���ƽ��״̬
���𰸡�D
��������
A.4minʱ����Ӧ��Ũ�Ƚ��ͣ���Ӧ��δ�ﵽƽ��״̬��������>������ѡ��A����
B.14minʱ�ı�����Ϊ�����¶ȣ���Ӧ���ʼӿ죬��16minƽ��ʱ���������ʶ�����8minʱ������ͼʾ��֪�����߾�����ƽ��״̬��ѡ��B����
C.��Ӧ��8minʱ��X��Ũ�ȱ仯��Ϊ1.0mol/L-0.2mol/L=![]() ������X�����ʵ���Ϊ0.8mol/L��1L=0.8mol�����ݷ���ʽ��֪����ӦӦ���ͷ�����Ϊ200kJ��ѡ��C����
������X�����ʵ���Ϊ0.8mol/L��1L=0.8mol�����ݷ���ʽ��֪����ӦӦ���ͷ�����Ϊ200kJ��ѡ��C����
D.�����������䣬����Ӧ�ھ��Ⱥ��������н��У���ѹǿ����ʱ��Ӧ�ʹ���ƽ��״̬��ѡ��D��ȷ��
��ѡD��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�����Ŀ����2L�ܱ������н��з�Ӧ��mX(g)��nY(g)![]() pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
���� | X | Y | Z | Q |
��ʼ/mol | 0.7 | 1 | ||
2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3minĩ/mol | 0.8 |
��֪��2min�ڣ���(Q)��0.075mol��L��1��min��1����(Z)�æ�(Y)��1��2��
��1������ʽ��m��______��n��______��p��______��q��______��
��2��2.5min�ڣ�Q��ת����Ϊ______________��
��3�����ڸ÷�Ӧ������������Ӧ���ʵĴ�ʩ��___________
A������������� B�����߲���Q C��ͨ�����X D�������¶�
��4���÷�Ӧ�ﵽ��ѧƽ��״̬ʱ___________
A������������ѹǿ���ֲ��� B�������������ܶȱ��ֲ���
C������������ƽ��Ħ���������ֲ��� D������Ӧ�������淴Ӧ�������