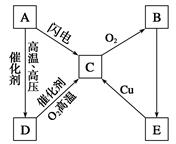
题目内容
(13分)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法师常用的处理方法。
(1)用化学方程式表示NO2形成酸雨的过程____________________________
(2)利用NH3和CH4等气体除去烟气中的氮氧化物。
①NH3的电子式
②热稳定性 NH3 CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l) △H1=akJ/mol; 欲计算反应CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓变 △H2则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=bkJ/mol,该反应的热化学方程式是__________________________据此计算出△H2= kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式______________________________________现有标况下的O233.6ml,理论上可以处理该氮氧化物______ml(标准状况下)。
(1) 3NO2 + H2O =2HNO3 + NO
(2)①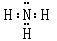
② >
③N2(g) + O2(g) = 2NO(g) △H ="b" KJ/mol
a — 2b
(3)①3O2 + 2NO + 6NO2 + 4Ca(OH)2=4Ca(NO3)2 + 4H2O
②89.6
解析试题分析:(2)②非金属性N大于C,故有热稳定性NH3大于CH4,③比较两个方程式相减再约分即得到需查询的反应为N2(g) + O2(g) = 2NO(g) △H ="b" KJ/mol,或逆反应也可以;再根据第一个反应减去该反应的两倍,即得出△H2="a" — 2bkJ/mol;(3)书写方程式时按 n(NO):n(NO2)=1:3配平方程式,设NO2、NO的物质的量分别为3x、x,根据电子守恒可以列式为:n(O2)=0.0015mol,
0.0015×4="3x×1+" x×3 x=0.001mol
气体体积为0.004×22.4×100=89.6mL
考点:以空气污染治理为背景综合考查物质结构、热化学方程式书写及反应热的计算、氧化还原方程式的书写及根据电子守恒计算等有关问题。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为 (用只含c的代数式表示)。
(2)填表。
| 表达要求 | 只含b的代数式 | 只含c的代数式 |
| a的取值范围 | | |
(3)写出只含c的代数式的推导过程。
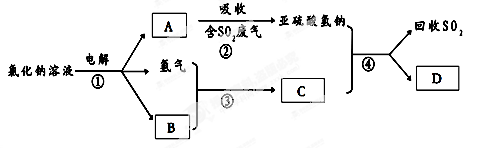
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
(1)该过程中能循环利用的物质为 。
(2)写出反应器中发生反应的离子方程式 。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。
已知浓硫酸的沸点为338oC,加热时酒精灯火焰的温度为400oC~500oC。
①甲同学用装置I(如下图)进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,该实验结论不能说明SO2能与BaCl2溶液发生反应,请解释生成该白色沉淀的两种可能原因(用文字和离子方程式表示):
,
;
②乙同学设计了装置Ⅱ(夹持装置和A的加热装置略去)进行实验,发现C中没有出现白色沉淀。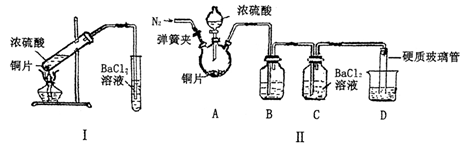
装置Ⅱ改进了装置I的四处不足,请填表说明另外的三处。
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| | |
| | |
| | |
a.NaOH溶液 b.H2O2溶液 C.新制氯水 d.酸性KMnO4溶液