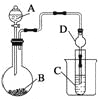
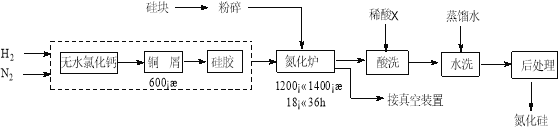
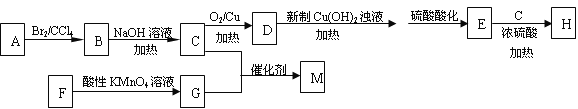
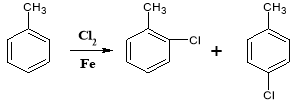
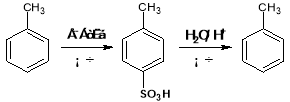
��Ŀ����
����Ŀ������һ�ֹ���Ԫ�أ�����������õĽ�������ش����и��⣺
��1�������к���һ����̼������(Fe3C)���������Ŀ����и������գ������д��ԵĹ������ʹ����ʯ��ˮ����ǵ����壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��������Ӧ���ɵĴ��Թ��������ڹ������ᣬ�÷�Ӧ�����ӷ���ʽΪ ��
��2����Fe2+��Fe3+�Ĵ������£���ʵ��2SO2+O2+2H2O=2H2SO4��ת������֪��SO2�ķ���ͨ�뺬Fe2+����Һʱ������һ����Ӧ�����ӷ���ʽΪ2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+������һ��Ӧ�����ӷ���ʽΪ ��
��3�����᳧�����ջ�����(FeS2)����ȡ���ᣬʵ�����������᳧����(��Ҫ�ɷ���Fe2O3������FeS��SiO2)���̷��������������̷��Ĺ������£�

����������ϡH2SO4�����У����ǹ���ֱ��ܽ⣬�����е��������ɣ�д���÷�Ӧ�����ӷ���ʽ(ֻд����S�����ӷ���ʽ��������Ӧ����д��) ��
������ҺX�м���������м��Ŀ���� ��
��ȡ1.6g���þ�����Ʒ�����Һ������ mL 0.1000 mol/L �����Ը������Һ�պ���ȫ��Ӧ��������ɵ���Ʒ�к�47.5%������������
��4����֪Fe(OH)3���ܶȻ�����Ksp��1.1��10-36������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpH=3ʱ��ͨ������˵��Fe3+�Ƿ�������ȫ ��
(��ʾ����ij����Ũ��С��1.0��10-5 molL-1ʱ������Ϊ�����ӳ�����ȫ��)
���𰸡���1��Fe3C + 3O2![]() Fe3O4 + CO2��Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O��
Fe3O4 + CO2��Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O��
��2��4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O��3����2Fe3+ + H2S = 2Fe2+ + S�� + 2H+
��ʹFe3+��ȫת��ΪFe2+�����Ʊ��������̷�������10.70
��4�������c(Fe3��)��1.1��10-3molL-1��1��10-5 molL-1����Fe3+û��������ȫ
��������
�����������1��Fe3C�������Ŀ����и����������������������Ͷ�����̼����ӦΪFe3C+3O2![]() Fe3O4+CO2�����Թ��������ڹ���ϡ���ᷢ��������ԭ��Ӧ������������NO��ˮ�����ӷ�ӦΪ3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O���ʴ�Ϊ��Fe3C+3O2
Fe3O4+CO2�����Թ��������ڹ���ϡ���ᷢ��������ԭ��Ӧ������������NO��ˮ�����ӷ�ӦΪ3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O���ʴ�Ϊ��Fe3C+3O2![]() Fe3O4+CO2��3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O��
Fe3O4+CO2��3Fe3O4+28H++NO3-=9Fe3++NO��+14H2O��
��2�����ܷ�Ӧ(2SO2+O2+2H2O=2H2SO4)��ȥ4Fe2++O2+4H+=4Fe3++2H2O�ɵõ����ӷ�ӦΪ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+���ʴ�Ϊ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3����Fe2O3���Ժ�ϡ����֮�䷴Ӧ������������FeS���Ժ�ϡ����֮�䷴Ӧ�������⣬�����Ӿ��������ԣ�������л�ԭ�ԣ�����֮��ᷢ����ѧ��Ӧ��2Fe3++H2S=2Fe2++S��+2H+����������ʣ��ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
������Һ�������м���������м�����������Ժ�������֮�䷴Ӧ�����������ӣ����Ʊ��������̷����壬�ʴ�Ϊ��ʹFe3+��ȫת��ΪFe2+�����Ʊ��������̷����壻
�������Ը��������Һ�����Ϊx�����������������������Ϊ�������ķ���ʽΪ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O�����ݷ���ʽ�У� =
=![]() �����x=0.0107L=10.70mL���ʴ�Ϊ��10.70��
�����x=0.0107L=10.70mL���ʴ�Ϊ��10.70��
��4����ҺpHΪ3ʱ����Һ��c(H+)=10-3����c(OH-)=10-11 ��Ksp=1.1��10-36=[c(OH-)]3��c(Fe3+)��c(Fe3+)=1.1��10-36/10-33=1.1��10-3(mol/L)��10-5 molL-1���ʴ�Ϊ��c(Fe3+)=1.1��10-3(mol/L)��10-5 molL-1��Fe3+û�г�����ȫ��

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�