题目内容
【题目】现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡___移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___pH(乙)(填“大于”、“小于”或“等于)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___V(乙)(填“大于”、“小于”或“等于”)。
(4)取25mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)____c(CH3COO-)(填“大于”、“小于”或“等于”)。
【答案】向右 减小 小于 大于 小于
【解析】
(1)醋酸是弱电解质,加水稀释促进醋酸电离,则电离平衡向向右移动;向醋酸中加入醋酸钠固体,导致溶液中醋酸根离子浓度增大,抑制醋酸电离,溶液中醋酸分子个数增大,氢离子个数减小,所以溶液中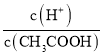 的比值减小,
的比值减小,
故答案为:向右;减小;
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍,稀释过程中,醋酸继续电离出氢离子,氯化氢完全电离,导致稀释后的溶液醋酸中氢离子浓度大于盐酸,所以其pH大小关系为:pH(甲)小于pH(乙),
故答案为:小于;
(3)中和相同浓度的NaOH溶液时,消耗NaOH溶液体积与酸的物质的量成正比,等pH的醋酸和盐酸,醋酸的浓度大于盐酸,所以等体积等PH的醋酸和盐酸,醋酸的物质的量大于盐酸,则醋酸消耗的NaOH体积大于盐酸,
故答案为:大于;
(4)pH=2的醋酸浓度大于0.01mol/L,pH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合,醋酸过量,导致溶液呈酸性,则c(H+)>c(OH),根据电荷守恒得c(Na+)<c(CH3COO),
故答案为:小于;

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】磷酸氯喹(C18H32ClN3O8P2)是当前治疗冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。完成下列填空:
(1)碳原子核外有__个轨道;氯原子最外层电子的轨道表示式是__。
(2)属于同主族的两种元素,非金属性大小的关系是__(用元素符号表示)。
(3)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释:__。
(4)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_c(CH3COOH)(填“<”、“>”、“=”)。
(5)向2.0L恒容的密闭容器中充入1.0molPCl5,发生如下反应:PCl5(s)PCl3(g)+C12(g)-124kJ。控制体系温度不变,反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
①该条件下平衡常数的表达式为__;前50s内Cl2的反应速率为__。
②要提高上述反应中反应物的转化率,可采取的措施有__、__(任写两点)。
向上述达到平衡③的反应体系中,再加入0.02molPCl3、0.02molC12,则平衡__。移动(选填“正向”、“逆向”、“不”),平衡常数__(选填“增大”、“减小”、“不变”)。
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
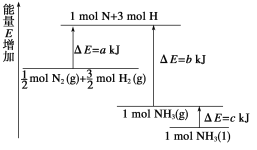
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
已知:①CH4、H2、CO的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l)=H2O(g);△H=+d kJmol-1
则△H1=____(用含字母a、b、c、d的代数式表示)kJmol-1。
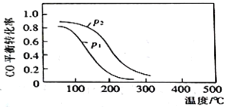
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2____(填“>”“<”或“ = ”)0。
②下列说法正确的是____(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=____mol L-1·min-1。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。