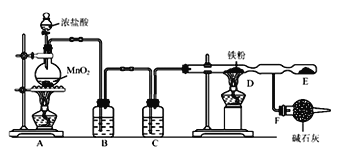
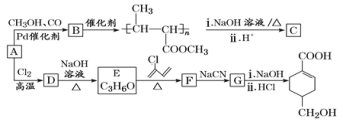
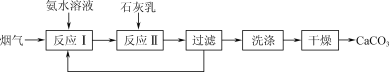
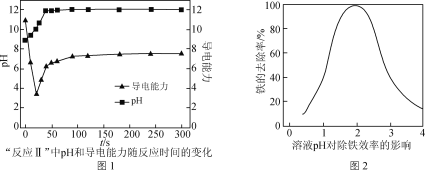
题目内容
【题目】磷酸氯喹(C18H32ClN3O8P2)是当前治疗冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。完成下列填空:
(1)碳原子核外有__个轨道;氯原子最外层电子的轨道表示式是__。
(2)属于同主族的两种元素,非金属性大小的关系是__(用元素符号表示)。
(3)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释:__。
(4)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_c(CH3COOH)(填“<”、“>”、“=”)。
(5)向2.0L恒容的密闭容器中充入1.0molPCl5,发生如下反应:PCl5(s)PCl3(g)+C12(g)-124kJ。控制体系温度不变,反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
①该条件下平衡常数的表达式为__;前50s内Cl2的反应速率为__。
②要提高上述反应中反应物的转化率,可采取的措施有__、__(任写两点)。
向上述达到平衡③的反应体系中,再加入0.02molPCl3、0.02molC12,则平衡__。移动(选填“正向”、“逆向”、“不”),平衡常数__(选填“增大”、“减小”、“不变”)。
【答案】5 ![]() N>P Na2HPO4=2Na++HPO42- HPO42-水解呈碱性,电离呈酸性,水解程度大于其电离程度,因而c(OH-)大于c(H+) = K=c(PCl3)c(C12) 0.0016mol·L-1·s-1 升高温度、降低压强 移走PCl3、Cl2等 逆向 不变
N>P Na2HPO4=2Na++HPO42- HPO42-水解呈碱性,电离呈酸性,水解程度大于其电离程度,因而c(OH-)大于c(H+) = K=c(PCl3)c(C12) 0.0016mol·L-1·s-1 升高温度、降低压强 移走PCl3、Cl2等 逆向 不变
【解析】
(1)利用碳原子核外电子排布式判断轨道数目,氯原子最外层电子的轨道表示式即价电子排布图;
(2)同主族元素从上到下,非金属性减弱;
(3)Na2HPO4属于弱酸的酸式盐,写出电离方程式,从电离和水解的角度分析,溶液成碱性;
(4)利用反应后的电荷守恒和醋酸钠的物料守恒联立,得出醋酸根和氯离子的关系;
(5)①根据表中数据判断达到平衡状态的时间,然后根据平衡状态下各组分的浓度及平衡常数表达式计算出温度为T时,该反应的化学平衡常数;根据反应速率的表达式计算出反应在前50s的平均速率v(Cl2);
②要提高上述反应的转化率,必须使平衡向着正向移动,根据影响化学平衡的影响进行判断;
③根据浓度熵与平衡常数的关系判断平衡移动的方向,温度不变,平衡常数不变;
(1)碳原子核外电子排布式为1s22s22p2,有个5轨道;氯原子的的外电子排布式为1s22s22p63s23p5,最外层电子的轨道表示式是![]() ;
;
(2)N和P属于同主族的两种元素,同主族元素,从上到下,失电子能力增强,得电子能力减弱,故非金属性减弱,故非金属性N>P;
(3)磷酸是弱电解质,Na2HPO4属于弱酸的酸式盐,电离方程式是Na2HPO4=2Na++HPO42-,Na2HPO4的水溶液里既存在磷酸氢根的电离,电离时释放出氢离子,HPO42-H++ PO43-,显酸性,也存在磷酸氢根的水解,HPO42-+H2O H2PO4-+OH-,呈弱碱性,溶液显碱性,说明HPO42-水解程度大于电离程度;
(4)醋酸钠溶液中加入盐酸,发生强酸制弱酸,CH3COONa+HCl=CH3COOH+NaCl,pH=7,说明c(H+)=c(OH-),反应后的溶液存在电荷守恒,即c(H+)+c(Na+)=c(CH3COO -)+c(OH-)+c(Cl-),醋酸钠溶液中存在物料守恒:即c(CH3COO -)+c(CH3COOH)=c(Na+),将钠离子的浓度代入电荷守恒,可以得到c(CH3COOH)=c(Cl-);
(5)①根据化学反应:PCl5(s) PCl3(g)+C12(g),得到化学平衡常数K=c(PCl3)c(Cl2),前50s内PCl3的反应速率为v=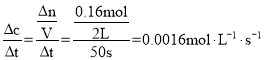 ,由于三氯化磷和氯气的物质的量是1:1的关系,故速率也是1:1的关系,故氯气的速率也是0.0016mol·L-1·s-1;
,由于三氯化磷和氯气的物质的量是1:1的关系,故速率也是1:1的关系,故氯气的速率也是0.0016mol·L-1·s-1;
②上述反应的正反应是一个气体分子数增大的吸热反应,因此,要提高上述反应中反应物的转化率,应使平衡正向移动,可采取的措施有升高温度、降低压强等;
③根据化学反应,列出三段式,

K=c(PCl3)c(Cl2)![]()
再加入0.02molPCl3、0.02molC12,此时的Qc=![]() >0.01(mol·L-1),平衡逆向移动;平衡常数只受温度的影响,故温度不变,平衡常数不变。
>0.01(mol·L-1),平衡逆向移动;平衡常数只受温度的影响,故温度不变,平衡常数不变。