题目内容
【题目】某溶液中有S2-、SO32-、Br-、I-四种阴离子各0.1mol。现通入Cl2,则通入Cl2的体积(标准状况)和溶液中相关离子的物质的量的关系图正确的是
A.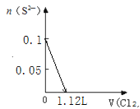 B.
B.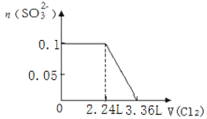
C.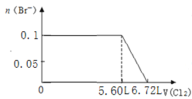 D.
D.
【答案】C
【解析】
离子还原性![]() ,故首先发生反应
,故首先发生反应![]() ,然后发生反应
,然后发生反应![]() ,再发生反应
,再发生反应![]() ,最后发生反应
,最后发生反应![]() ,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积。
,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积。
A.由![]() 可知,
可知,![]() 完全反应需要消耗
完全反应需要消耗![]() 氯气,标准状况下的
氯气,标准状况下的![]() 的体积为0.1mol
的体积为0.1mol![]() 22.4L·mol-1=2.24L,图象中氯气的体积不符合,A错误;
22.4L·mol-1=2.24L,图象中氯气的体积不符合,A错误;
B.![]() 完全反应后,才发生
完全反应后,才发生![]() ,
,![]() 完全反应需要消耗
完全反应需要消耗![]() 氯气,故开始反应时氯气的体积为
氯气,故开始反应时氯气的体积为![]() ,
,![]() 完全反应消耗
完全反应消耗![]() mol氯气,故
mol氯气,故![]() 完全反应时氯气的体积为
完全反应时氯气的体积为![]() ,图象中氯气的体积不符合,B错误;
,图象中氯气的体积不符合,B错误;
C.![]() 完全反应需要消耗
完全反应需要消耗![]() 氯气,
氯气,![]() 完全反应消耗
完全反应消耗![]() mol氯气,
mol氯气,![]() 完全反应消耗
完全反应消耗![]() 氯气,故溴离子开始反应时氯气的体积为
氯气,故溴离子开始反应时氯气的体积为![]() ,由
,由![]() 可知,
可知,![]() 完全反应消耗
完全反应消耗![]() mol氯气,故Br-完全反应时消耗的氯气体积为
mol氯气,故Br-完全反应时消耗的氯气体积为![]() ,图象与实际符合,C正确;
,图象与实际符合,C正确;
D.![]() 完全反应需要消耗
完全反应需要消耗![]() 氯气,
氯气,![]() 完全反应消耗
完全反应消耗![]() mol氯气,
mol氯气,![]() 完全反应消耗
完全反应消耗![]() mol氯气,故I
mol氯气,故I![]() 完全时消耗的氯气体积为
完全时消耗的氯气体积为![]() ,图象中氯气的体积不符合,D错误。
,图象中氯气的体积不符合,D错误。
答案选C。

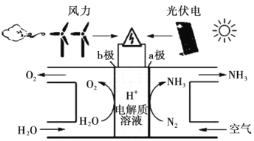
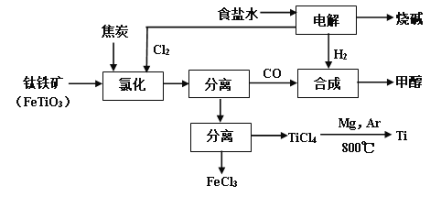
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗