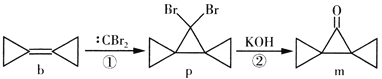
题目内容
【题目】(1)称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
①若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
②若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_______________。
(2)写出下列离子方程式
①金属钠投入CuSO4溶液_____________________ 。②向饱和食盐水中通入足量氨气和二氧化碳:___________.
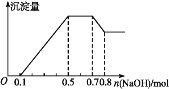
(3)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_______,当x=3.6时,Al(OH)3的质量为________.
【答案】偏小 偏小 偏小 偏大 2Na+Cu2++ 2H2O=H2↑+Cu(OH)2↓+2Na+ Na++NH3+CO2+H2O=NaHCO3↓+NH4+ 3<x<4 31.2g
【解析】
(1)采用极值法进行首先计算出等质量的碳酸钠与盐酸反应消耗盐酸和生成二氧化碳气体的量,然后再计算等质量的K2CO3、NaHCO3分别与盐酸反应消耗盐酸和生成二氧化碳气体的量,进行对比可以得出结论;
(2)①金属钠投入CuSO4溶液中,钠先与水反应,生成氢氧化钠和氢气,生成的氢氧化钠再与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,据此写出离子方程式;
②氯化钠和氨气、二氧化碳、水共同作用生成碳酸氢钠和氯化铵,据此写出离子方程式;
(3)根据氯化铝的物质的量是1mol,恰好全部转化为氢氧化铝时:Al3++3OH-=Al(OH)3↓,消耗氢氧化钠是3mol,恰好转化为偏铝酸钠时:Al3++4OH—=AlO2—+2H2O,消耗氢氧化钠是4mol,据此进行分析当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围;当x=3.6时,生成的氢氧化铝部分溶解,根据上述反应关系,求出剩余Al(OH)3的质量。
(1)纯碱与盐酸反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,设mg Na2CO3与盐酸反应,则消耗盐酸物质的量为2×m/106=m/53mol,生成气体物质的量m/106mol;
①若纯碱中混有K2CO3,反应为K2CO3+2HCl=2KCl+CO2↑+H2O,设mg K2CO3与盐酸反应,则消耗盐酸2×m/138=m/69mol,生成气体m/138mol, 因此若纯碱中混有K2CO3,盐酸用量将偏小,气体产量也偏小;
综上所述,本题答案是:偏小,偏小 。
②若纯碱中混有NaHCO3,反应为NaHCO3+HCl=KCl+CO2↑+H2O,设mg NaHCO3与盐酸反应,则消耗盐酸m/84mol,生成气体m/84mol, 因此若纯碱中混有NaHCO3,盐酸用量将偏小,气体产量也偏大;
综上所述,本题答案是:偏小,偏大 。
(2)①金属钠投入CuSO4溶液中,钠先与水反应,生成氢氧化钠和氢气,生成的氢氧化钠再与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,把2个反应合二为一,离子方程式为:2Na+Cu2++2H2O=H2↑+Cu(OH)2↓+2Na+;
综上所述,本题答案是:2Na+Cu2++2H2O=H2↑+Cu(OH)2↓+2Na+ 。
②氯化钠和氨气、二氧化碳、水共同作用生成碳酸氢钠和氯化铵,离子方程式为:Na++NH3+CO2+H2O=NaHCO3↓+NH4+;
综上所述,本题答案是:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ 。
(3)氯化铝的物质的量是1mol,恰好全部转化为氢氧化铝时:Al3++3OH-=Al(OH)3↓,消耗氢氧化钠是3mol,恰好转化为偏铝酸钠时:Al3++4OH—=AlO2—+2H2O,消耗氢氧化钠是4mol,所以当铝元素以Al(OH)3和AlO2-形式存在时![]() 的取值范围是3<x<4;当x=3.6时生成的氢氧化铝部分溶解,与氢氧化铝反应的氢氧化钠是3.6-3=0.6mol,根据方程式Al(OH)3+OH-=AlO2-+2H2O可知消耗氢氧化铝是0.6mol,剩余氢氧化铝是1-0.6=0.4mol,质量是0.4mol×78g/mol=31.2g。
的取值范围是3<x<4;当x=3.6时生成的氢氧化铝部分溶解,与氢氧化铝反应的氢氧化钠是3.6-3=0.6mol,根据方程式Al(OH)3+OH-=AlO2-+2H2O可知消耗氢氧化铝是0.6mol,剩余氢氧化铝是1-0.6=0.4mol,质量是0.4mol×78g/mol=31.2g。
综上所述,本题答案是:3<x<4;31.2g。

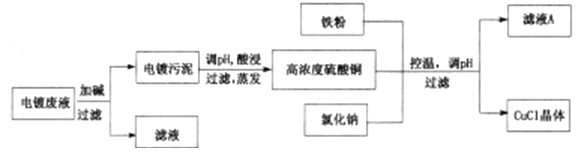
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
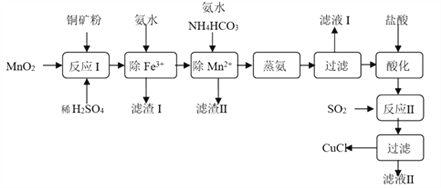
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
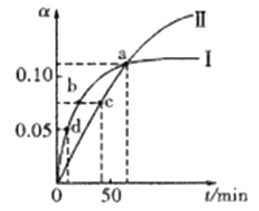
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2