题目内容
14.25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是( )| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | V[C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| C. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| D. | V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
分析 A.25℃时,pH>7的溶液呈碱性;
B.V[C6H5OH(aq)]=20mL时,溶液中的溶质为苯酚和苯酚钾,任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.pH<7时,该温度下溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
D.当V[C6H5OH(aq)]=10mL时,二者恰好反应生成苯酚钾,苯酚钾是强碱弱酸盐,其溶液呈碱性.
解答 解:A.25℃时,pH>7的溶液呈碱性,则c(H+)<c(OH-),故A错误;
B.V[C6H5OH(aq)]=20mL时,溶液中的溶质为苯酚和苯酚钾,任何电解质溶液中都存在物料守恒,根据物料守恒得c(C6H5O-)+c(C6H5OH)=2c(K+),故B正确;
C.pH<7时,该温度下溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(K+)<c(C6H5O-),故C错误;
D.当V[C6H5OH(aq)]=10mL时,二者恰好反应生成苯酚钾,苯酚钾是强碱弱酸盐,其溶液呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(K+)>c(C6H5O-),盐类水解较微弱,所以离子浓度大小顺序是c(K+)>c(C6H5O-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题以酸碱中和为载体考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意电荷守恒、物料守恒的灵活运用,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
4.对于如图的叙述错误的是( )


| A. | 图示实验中发生了化学变化 | |
| B. | 液体X溶液的pH>7,液体Y是一种黑色黏稠状液体 | |
| C. | 气体Z易燃,可还原CuO,也可使溴水褪色 | |
| D. | 试管A中产生浓的白烟 |
5.卤族元素的单质和化合物很多我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)已知高碘酸有两种形式,化学式分别为H5IO6(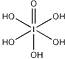 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
2.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列物质熔化时所克服的微粒间的作用力与氮化硼熔化所克服的微粒间的作用力都相同的是( )
| A. | 氯化钠 | B. | 二氧化硅 | C. | 干冰 | D. | 二氧化硫 |
19.下列烃及烃的高聚物:①乙烷;②苯;③聚丙烯;④聚异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧裂解气,能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
| A. | ②③④⑤⑥⑦⑧ | B. | ③④⑤⑥⑦⑧ | C. | ④⑤⑧ | D. | ④⑤⑦ |
6.下列说法正确的是( )
| A. | 硫酸的摩尔质量为98g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 1 mol H2O的质量为18g/mol | |
| D. | 1mol任何物质实际都约含有6.02×1023个原子 |
3.下列物质:①KMnO4 ②HCHO(甲醛) ③MgSO4 ④NH4Cl ⑤KOH ⑥Hg(NO3)2中,能使蛋白质变性的是( )
| A. | ②④⑥ | B. | ①③⑤ | C. | ①②③⑥ | D. | ①②⑤⑥ |
16.(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①Na2CO3和NaOH,②Na2CO3,③Na2CO3和NaHCO3,④NaHCO3.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
①甲瓶溶液为AlCl3溶液.
②乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
②乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.