题目内容
19.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体 | |
| D. | 工业上电解熔融的MgCl2,可制得金属镁 |
分析 A.Al(OH)3胶体具有较大的表面积,有吸附性;
B.Zn与Fe形成原电池时,Fe作正极被保护;
C.根据分散系中分散质粒子直径大小分类;
D.镁可用电解法冶炼.
解答 解:A.明矾在水中电离的铝离子能水解生成Al(OH)3胶体,Al(OH)3胶体具有较大的表面积,有吸附性,能吸附水中的悬浮物,可用于水的净化,故A正确;
B.Zn与Fe形成原电池时,Zn的活泼性比Fe强,Fe作正极被保护,所以在海轮外壳上镶入锌块,可减缓船体的腐蚀速率,故B正确;
C.根据分散系中分散质粒子直径大小将分散系分为溶液、胶体和浊液,故C错误;
D.工业上电解熔融的MgCl2,可制得金属镁,故D正确.
故选C.
点评 本题考查了胶体性质的应用、原电池原理的应用、分散系、金属的冶炼等,题目难度不大,侧重于基础知识的考查,注意对有关原理的掌握.

练习册系列答案
相关题目
15.下列实验方法或操作能达到实验目的是( )


| A. | 图1:石油分馏 | B. | 图2:配制150mL 0.1mol/L盐酸 | ||
| C. | 图3:烧瓶内溶液变蓝色 | D. | 图4:探究NaHCO3的热稳定性 |
10.目前“低碳经济”正成为科学家研究的主要课题.请回答下列问题:
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
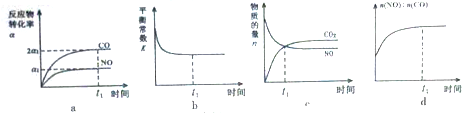
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).
Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
请回答:
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).

Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
7.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si |
14.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液呈中性 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
8.如表实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
9.列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | Na2O、Na2O2与CO2反应产物相同 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |