题目内容
9.列有关物质的性质或应用的说法不正确的是( )| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | Na2O、Na2O2与CO2反应产物相同 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
分析 A.光纤制品的主要成份是二氧化硅;
B.水玻璃即为硅酸钠水溶液具有黏性;
C.Na2O2与CO2发生化合生成Na2CO3和氧气;
D.SiO2是酸性氧化物,能与碱反应.
解答 解:A.光纤制品的主要成份是二氧化硅,故A正确;
B.水玻璃即为硅酸钠水溶液具有黏性,工业上可以用于生产黏合剂,硅酸钠溶液涂刷或浸入木材后,能渗入缝隙和孔隙中,固化的硅凝胶能堵塞毛细孔通道,提高材料的密度和强度,且硅凝胶具有很强的耐高温性质,因此可以有效的防火,故B正确;
C.Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生化合生成Na2CO3和氧气,故C错误;
D.因SiO2是酸性氧化物,能与碱反应:SiO2+2NaOH=Na2SiO3+H2O,故D正确.
故选C.
点评 本题主要考查了SiO2的化学性质,难度不大,需要强调的是SiO2作为酸性氧化物,但也不完全具有酸性氧化物的通性.

练习册系列答案
相关题目
19.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体 | |
| D. | 工业上电解熔融的MgCl2,可制得金属镁 |
20.下列有关粒子的表示方法正确的是( )
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: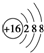 | ||
| C. | 氯气分子的结构式:Cl-Cl | D. | H2O2的电子式: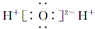 |
17.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 粗铜板作阳极,电解硫酸铜溶液 | 粗铜溶解,纯铜在阴极上析出 | Cu 放电是氧化剂 |
| B | 向银氨溶液中滴加几滴乙醛后 水浴加热 | 银附着在试管壁上 | 乙醛发生还原反 应 |
| C | 向含 I-的无色溶液中滴加少量 新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向 FeSO4溶液中先滴入 KSCN 溶液再滴加 H2O2 溶液 | 加入 H2O2后溶液变成血红色 | Fe2+既有氧化性又 有还原性 |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法正确的是( )
| A. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| C. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 | |
| D. | 纯净的硫酸是纯净物,而纯净的盐酸是混合物 |
14.X、Y、Z三种气体,当X和Y按1:2的物质的量之比混合并通入密闭容器进行反应:X+2Y?2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
| A. | 70% | B. | 60% | C. | 50% | D. | 40% |
18.下列有关NA数值的说法正确的是( )
| A. | ag乙烯和丙烯混合物中所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压下,18g重水中含有的中子数为8NA | |
| C. | 标准状况下,2.24LCl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 7.8gNa2O2中含有的阴离子数为0.2NA |
19.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+、Mn${O}_{4}^{-}$、Cl-、${SO}_{4}^{2-}$ | B. | Na+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl- | ||
| C. | ${NO}_{3}^{-}$、Na+、${HCO}_{3}^{-}$、Mg2+ | D. | Na+、${NO}_{3}^{-}$、H+、${SO}_{4}^{2-}$ |
