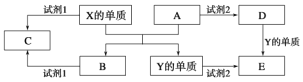
题目内容
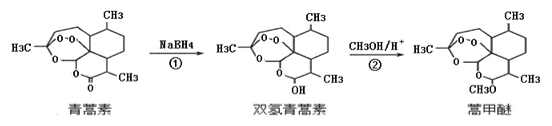
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,器合成路线如下:
下列说法不正确的是()
A. 青蒿素的分子式是C15H22O5,属于烃的衍生物
B. 双氢青蒿素中含有过氧键,遇湿润的淀粉碘化钾试纸立刻显蓝色
C. 蒿甲醚可以犮生水解反应
D. 反应②为取代反应,有H2O生成
【答案】C
【解析】A.根据结构简式确定分子式为C15H22O5,青蒿素中含有C、H、O元素,属于烃的衍生物,A正确;B.青蒿素中含有过氧键,具有强氧化性,过氧键氧化碘离子生成碘而使湿润的淀粉碘化钾溶液变蓝色,B正确;C.蒿甲醚不存在酯基,不能发生水解反应,C错误;D.该反应中醇羟基变为醚键,所以该反应属于取代反应,且有水生成,D正确;答案选C。

 优学名师名题系列答案
优学名师名题系列答案【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。
【题目】实验室欲配制1mol/L NaOH溶液240ml,请回答:
(1)需称取NaOH固体____________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项____________(填字母)。
附表砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
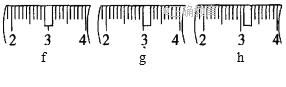
(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________