题目内容
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)
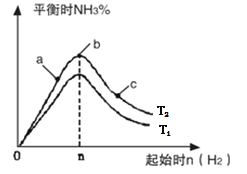
①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
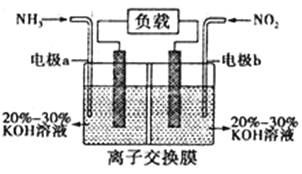
①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H = -92.4kJ/mol 低于 C 25/12 或2.08或2.1 AC 负 2NH3—6e—+6OH—=N2+6H2O 0.4 阴离子
2NH3(g) △H = -92.4kJ/mol 低于 C 25/12 或2.08或2.1 AC 负 2NH3—6e—+6OH—=N2+6H2O 0.4 阴离子
【解析】(1)①H2(g)+![]() O2(g)=H2O(l)△H1=-285.8 kJmol-1;②4NH3 (g) +5O2 (g)
O2(g)=H2O(l)△H1=-285.8 kJmol-1;②4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H2= —1168.8kJ/mol ;③N2(g)+ O2(g)═ 2NO(g)△H3 = +180.6kJ/mol;根据盖斯定律可知,③+①×3-②×
4NO(g) + 6H2O(l) △H2= —1168.8kJ/mol ;③N2(g)+ O2(g)═ 2NO(g)△H3 = +180.6kJ/mol;根据盖斯定律可知,③+①×3-②×![]() 可得:N2(g)+3H2(g)2NH3(g),则△H=(+180.6kJ/mol)+(-285.8 kJmol-1)×3-(—1168.8kJ/mol)×
可得:N2(g)+3H2(g)2NH3(g),则△H=(+180.6kJ/mol)+(-285.8 kJmol-1)×3-(—1168.8kJ/mol)×![]() =-92.4 kJmol-1;
=-92.4 kJmol-1;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为c;
③当氮气和氢气的物质的量之比为1∶3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1.2mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,据K=![]() =
=![]() =2.08;
=2.08;
(3)A.b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;B.c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;C.b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;D.c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;故答案为AC。
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O;
②当有0.1molNO2 被处理时,转移电子为0.1mol×(4-0)=0.4mol;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作。