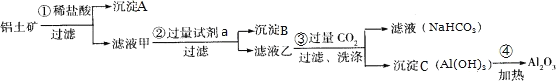
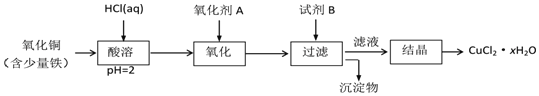
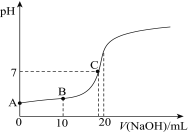
题目内容
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
【答案】96% 24 23%
【解析】
(1)在生成的硫酸盐中,硫、氧元素质量分数之和为80%,则金属M的质量分数为(1—80%)即20%,可以据此解答;
(2)根据金属元素可能的化合价带入进行计算,然后完成解答;
(3)根据(2)的解答求出溶质的质量,然后结合溶质的质量分数的计算公式完成解答即可。
(1)在生成的硫酸盐中,硫、氧元素质量分数之和为80%,则金属M的质量分数为(1—80%)即20%;硫酸盐中的硫、氧元素来自硫酸,故硫、氧元素的质量和为:![]() =9.6g,硫酸盐中金属的质量=
=9.6g,硫酸盐中金属的质量=![]() =2.4g,则样品中金属的质量分数为:
=2.4g,则样品中金属的质量分数为:![]() =96%;
=96%;
(2)根据上述分析可以知道该硫酸盐的相对分子质量为![]() =120,即金属M的相对原子质量=120-96=24;
=120,即金属M的相对原子质量=120-96=24;
讨论:若金属在硫酸盐中呈+1价,则
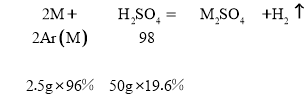
得金属的相对原子质量A(M)=![]() =12 (不合题意,舍去)。
=12 (不合题意,舍去)。
讨论:若金属在硫酸盐中呈+2价,则
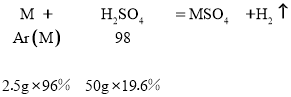
得金属的相对原子质量A(M) =![]() =24,(符合题意)
=24,(符合题意)
讨论:若金属在硫酸盐中呈+3价,则
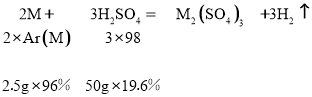
得金属的相对原子质量Ar(M)= ![]() =36(不合题意,舍去)
=36(不合题意,舍去)
(3)设完全反应后,生成硫酸盐的质量为x,生成氢气的质量为y,则
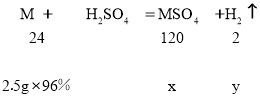
得x=12g ,y=0.2g,所得溶液中溶质的质量分数为:![]() =23%。
=23%。

练习册系列答案
相关题目