题目内容
【题目】ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是_______________________。
(2)气态氢化物稳定性:NH3 ______________ AsH3,其主要原因是___________________。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被NH2(氨基)取代形成的另一种氮的氢化物。则N2H4电子式为_______________。
②工业上将NH3或(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为_______________,1 mol(CH3)2 CO中的π键数目为___________。
③N2H4分子中存在的共价键类型有________(填选项字母)。
A.非极性键 B.极性键 C.s-s σ键 D.s-p σ键
E.p-p π键 F.s-sp3 σ键 G.sp3-sp3 σ键 H.sp3-sp3 π键
(4)已知N2H5+与N2H62+是由中性分子结合质子形成的,有类似于 NH4+的性质。
①写出N2H62+在碱性溶液中反应的离子方程式:_________________________________。
②据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____________。
(5)Na3AsO4可作杀虫剂。AsO![]() 的空间构型为__________,与其互为等电子体的一种分子为________。
的空间构型为__________,与其互为等电子体的一种分子为________。
(6)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为__________,砷原子采取___________杂化。
 .
.
【答案】 溴 大于 AsH3键长大于NH3,故AsH3的键能小于NH3,故稳定性差 略 sp2,sp3 NA A、B、F、G N2H62++2OH-=N2H4+2H2O +1 正四面体 CCl4(或其他合理答案) As4O6 sp3
【解析】(1)As的核外电子排布式为[Ar]3d104s24p3,为第四周期ⅤA族的元素,溴原子核外电子排布式为[Ar]3d104s24p7,同一周期,随原子序数的增加,元素第一电离能呈现增大的趋势,所以As的第一电离能小于同周期第ⅦA族的Br元素,正确答案:溴
(2)根据元素周期律可知:同主族元素从上到下随原子序数的递增,原子半径越来越大,N-H的键长比As-H短,键能大,所以NH3比AsH3稳定,正确答案:大于;AsH3键长大于NH3,AsH3的键能小于NH3,所以稳定性差;
(3)①根据题干信息:NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物是肼,结构中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为,![]() ,正确答案:
,正确答案:![]() ;
;
②(CH3)2CO中甲基上的碳原子周围与4个原子相连,呈四面体结构,所以杂化方式是sp3;(CH3)2CO中羰基上的碳原子周围与3个原子相连,呈平面三角形结构,所以杂化方式是sp2,1个(CH3)2CO中含有1个π键,所以1mol (CH3)2CO中的π键数目为:NA,正确答案为: sp3杂化;sp2杂化;NA;
③N2H4分子的结构式是:![]() ,N原子是SP3杂化,所以N—H之间是极性键,原子间形成的单键都是σ键,所以N—H是s-sp3 σ键,N-N原子之间是非极性键,也是sp3-sp3 σ键,所以N2H4分子中存在的共价键类型有A、B、F、G,正确答案:A、B、F、G;
,N原子是SP3杂化,所以N—H之间是极性键,原子间形成的单键都是σ键,所以N—H是s-sp3 σ键,N-N原子之间是非极性键,也是sp3-sp3 σ键,所以N2H4分子中存在的共价键类型有A、B、F、G,正确答案:A、B、F、G;
(4)①根据题干的信息:N2H5+与N2H62+是由中性分子N2H4结合质子形成的有类似于 NH4+的性质,N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,正确答案为:N2H62++2OH-=N2H4+2H2O;
②N5结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N≡N键,满足条件的结构为: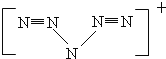 ,故“N5”带一个单位正电荷,正确答案为:一个单位正电荷;
,故“N5”带一个单位正电荷,正确答案为:一个单位正电荷;
(5)根据AsO43-的结构可知,As的最外层电子数是5,根据ABm型分子的价电子对计算方法得:价电子对数=(5+0×4+3)÷2=4,其空间构型是正四面体;等电子体是指价电子数和原子数分别都相等的物质,AsO43-中价电子数是5+6×4+3=32,所以与其互为等电子体的是分子有CCl4,正确答案:正四面体 ;CCl4;
(6)根据砒霜的分子结构图可知,分子式为As4O6,由于化学键都是单键,所以是sp3杂化,正确答案:As4O6;sp3。