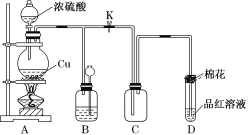
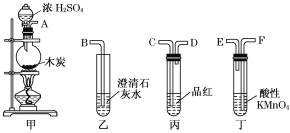
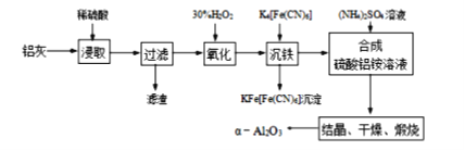
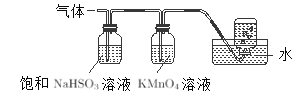
题目内容
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
【答案】量筒 烧杯玻璃棒500mL容量瓶胶头滴管AEFDCB13.6使稀释浓硫酸放出的热量迅速散去偏低
【解析】
(1)根据配制500mL 0.5mol/L稀硫酸的步骤可知,配制过程中使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;(2)配制500mL 0.5mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确的操作顺序为:AEFDCB;(3)500mL 0.5mol/L的稀硫酸中含有溶质硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,设需要98%浓硫酸(密度1.84g/cm3)的浓硫酸的体积为VL:则![]() ,解得V≈0.0136L=13.6mL;(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,浓硫酸稀释过程放出大量的热量,需要通过玻璃棒的搅拌使稀释浓硫酸放出的热量迅速散去;若溶液部分溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低。
,解得V≈0.0136L=13.6mL;(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,浓硫酸稀释过程放出大量的热量,需要通过玻璃棒的搅拌使稀释浓硫酸放出的热量迅速散去;若溶液部分溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目