题目内容
【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: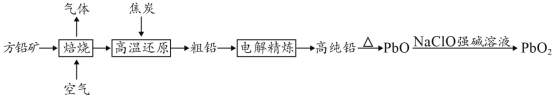
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
【答案】酸雨 增大方铅矿与空气的接触面积,加快化学反应速率 铜、银 ClO-+PbO=PbO2+Cl- PbCl2覆盖在铅表面,阻止反应的进一步进行 假设能发生反应:Pb2++H2S=PbS↓+2H+,该反应的平衡常数![]() ,反应可进行完全,故有PbS沉淀生成
,反应可进行完全,故有PbS沉淀生成
【解析】
方铅矿中通入空气焙烧,发生反应2PbS+3O2![]() 2SO2+2PbO,加入焦炭还原,发生反应PbO+C
2SO2+2PbO,加入焦炭还原,发生反应PbO+C![]() Pb+CO↑,得到粗铅,通过电解精炼得到纯Pb,Pb加热得到PbO,将PbO投入NaClO溶液中得到PbO2,发生的反应为ClO-+PbO═PbO2+Cl-,据此分析解答。
Pb+CO↑,得到粗铅,通过电解精炼得到纯Pb,Pb加热得到PbO,将PbO投入NaClO溶液中得到PbO2,发生的反应为ClO-+PbO═PbO2+Cl-,据此分析解答。
(1)焙烧时发生的反应为2PbS+3O2![]() 2SO2+2PbO,生成的气体是SO2,可导致酸雨,“焙烧”前须将方铅矿研磨粉粹,可增大方铅矿与空气的接触面积,加快化学反应速率,故答案为:酸雨;增大方铅矿与空气的接触面积,加快化学反应速率;
2SO2+2PbO,生成的气体是SO2,可导致酸雨,“焙烧”前须将方铅矿研磨粉粹,可增大方铅矿与空气的接触面积,加快化学反应速率,故答案为:酸雨;增大方铅矿与空气的接触面积,加快化学反应速率;
(2)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时,粗Pb作阳极、纯Pb作阴极,Zn、Fe比Pb活泼,所以阳极上Zn、Fe和Pb失电子生成离子进入溶液,铅的活泼性大于铜、银,铅先放电,阳极泥的主要成分为铜、银,故答案为:铜、银;
(3),根据流程图,制备PbO2的离子方程式为ClO-+PbO=PbO2+Cl-,故答案为:ClO-+PbO=PbO2+Cl-;
(4)①铅与稀盐酸反应生成氯化铅和氢气,生成的氯化铅难溶于水,PbCl2覆盖在铅表面,阻止反应的进一步进行,因此产生少量气泡后反应终止,故答案为:PbCl2覆盖在铅表面,阻止反应的进一步进行;
②假设能发生反应Pb2++H2S═PbS↓+2H+,该反应的电离平衡常数K=![]() =
=![]() =1.0×107>105,所以该反应能进行完全,所以有PbS沉淀生成,故答案为:假设能发生反应Pb2++H2S═PbS↓+2H+,该反应的电离平衡常数K=
=1.0×107>105,所以该反应能进行完全,所以有PbS沉淀生成,故答案为:假设能发生反应Pb2++H2S═PbS↓+2H+,该反应的电离平衡常数K=![]() =
=![]() =1.0×107>105,反应能进行完全,有沉淀PbS生成。
=1.0×107>105,反应能进行完全,有沉淀PbS生成。

【题目】X、Y、Z三种物质直接的转化如图所示,其中不能一步实现的是( )

A | B | C | D | |
X | C | NaOH | CH3CH2OH | N2 |
Y | CO | Na2CO3 | CH3CHO | NH3 |
Z | CO2 | NaHCO3 | CH3COOH | NO2 |
A.AB.BC.CD.D
【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的工艺流程如图所示,回答下列问题。
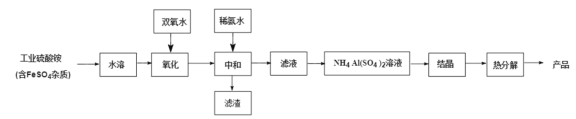
(1)“氧化”步骤发生的离子方程式为:________, 使用双氧水作氧化剂优点为:______________。
(2)“热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为______________。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失
重计算值( 失重计算值(%)![]() )如表所示:
)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在______________温度区间铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是_____
(5)该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:______________。
(6)通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=______________(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。