题目内容
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
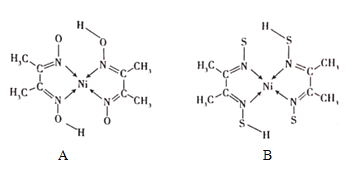
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
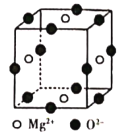
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
【答案】3d N2 CN- sp3和sp2 30NA A分子间存在氢键 ACD 91:6 Mg2NiO3
【解析】
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为3d;
(2)原子数与价电子数分别都相等的互为等电子体;
(3)(1)根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;C-H为碳氢σ键,C-C为碳碳σ键,C=N含有一个碳氮σ键;
(4)①A分子中含有-OH,分子间易形成氢键;
②根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;根据碳原子成键类型判断。
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,据此计算x:y;
(6)根据晶胞中原子分摊计算Mg2+、O2-的数目分别为2、3,再根据化合物中化合价代数和为0计算Ni2+的数目。
(1)Ni的原子序数是28,因此基态Ni原子中,电子填充的能量最高的能级符号为3d,故答案为:3d;
(2)原子数与价电子数分别都相等的互为等电子体,则与CO互为等电子体的分子为N2,与CO互为等电子体的阴离子为CN-等;故答案为:N2;CN-;
(3)丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA,2mol丁二酮肟含有σ键数目为30NA,故答案为:sp3和sp2;30NA;
(4)①A分子中含有-OH,分子间易形成氢键,B分子不能形成氢键,故答案为:A分子间存在氢键;
②根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选ACD,故答案为:ACD;
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,解得:x:y=91:6,故答案为:91:6;
(6)晶胞中原子分摊得到Mg2+的数目=4×![]() =2,O2-的数目=12×
=2,O2-的数目=12×![]() =3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。
=3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。

【题目】物质的量相同的NaHCO3和KHCO3固体混合物9.20g与0.2mol/L盐酸反应。
(1)欲求标准状况下生成CO2的体积,还需要什么数据___。(讨论(2)的问题中,该数据用a表示)
a | 生成CO2的体积(L) |
(2)讨论a值的变化时,产生CO2的体积(标准状况)___