题目内容
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
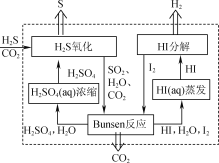
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
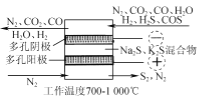
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
【答案】1∶1 2HI(g)![]() H2(g)+I2(g);ΔH=+26 kJ/mol SO2+I2+2H2O=4H++SO42-+2I- 2S2--4e-=S2 COS+2e-=S2-+CO 通入足量O2(或空气) Fe3+浓度增大,pH减小,使反应 (Ⅰ)、(Ⅱ)向逆反应方向移动且pH减小因素超过反应(Ⅲ) Fe3+浓度增大因素
H2(g)+I2(g);ΔH=+26 kJ/mol SO2+I2+2H2O=4H++SO42-+2I- 2S2--4e-=S2 COS+2e-=S2-+CO 通入足量O2(或空气) Fe3+浓度增大,pH减小,使反应 (Ⅰ)、(Ⅱ)向逆反应方向移动且pH减小因素超过反应(Ⅲ) Fe3+浓度增大因素
【解析】
(1)①“H2S氧化”为H2S与浓硫酸的反应产生S单质、SO2和H2O,结合电子守恒计算;
②1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,结合状态及焓变书写热化学方程式;
③“Bunsen反应”中反应物为二氧化硫、碘、水,生成物为硫酸和HI;
(2)阳极上硫离子失去电子,阴极上COS得到电子;
(3)①吸收液经过滤出S后,滤液需进行再生,可利用氧气氧化亚铁离子;
②图中当Fe3+的浓度大于10 g/L时,浓度越大,酸性增强,导致脱硫率越低。
(1)①“H2S氧化”为H2S与浓硫酸的反应,由电子守恒可知,反应中氧化剂与还原剂的物质的量之比为![]() =
=![]() ;
;
②1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,结合状态及焓变可知热化学方程式为2HI(g)![]() H2(g)+I2(g)△H=+26kJ/mol;
H2(g)+I2(g)△H=+26kJ/mol;
③“Bunsen反应”中反应物为二氧化硫、碘、水,生成物为硫酸和HI,离子反应为SO2+I2+2H2O=4H++SO42-+2I-;
(2)由电化学干法氧化法脱除H2S的原理图2可知,阳极发生的电极反应为2S2--4e-═S2;阴极上COS发生的电极反应为COS+2e-═S2-+CO;
(3)①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是通入足量O2(或空气),
故答案为:通入足量O2(或空气);
②图中当Fe3+的浓度大于10 g/L时,浓度越大,脱硫率越低,这是由于Fe3+浓度增大,pH减小,使反应(Ⅰ)、(Ⅱ)向逆反应方向移动且pH减小因素超过反应(Ⅲ) Fe3+浓度增大因素。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案