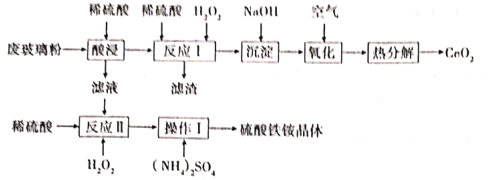
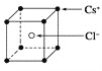
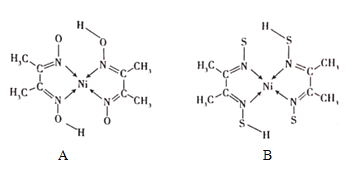
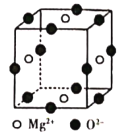
题目内容
【题目】物质的量相同的NaHCO3和KHCO3固体混合物9.20g与0.2mol/L盐酸反应。
(1)欲求标准状况下生成CO2的体积,还需要什么数据___。(讨论(2)的问题中,该数据用a表示)
a | 生成CO2的体积(L) |
(2)讨论a值的变化时,产生CO2的体积(标准状况)___
【答案】盐酸的体积aL 盐酸不足量时:a<0.5L,4.48a L;盐酸足量时:a≥0.5L,2.24 L
【解析】
(1)碳酸氢盐与盐酸按1:1反应,盐酸不足量,碳酸氢盐有剩余,应根据HCl的物质的量计算二氧化碳的体积;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:(84 g·mol-1+100 g·mol-1)×ymol=9.20 g,解得y=0.05mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.100 mol,M(HCl)=1.00mol·L-1,①当盐酸不足量,即a<0.5L时,按HCl量计算V(CO2);
②当盐酸足量,即a≥0.5L时,按HCO3-的量计算V(CO2);
(1)碳酸氢盐与盐酸按1:1反应,盐酸不足量,碳酸氢盐有剩余,应根据HCl的物质的量计算二氧化碳的体积,所以要计算生成CO2的体积,0.2mol·L-1盐酸,还需要知道盐酸的体积aL,故答案为:盐酸的体积aL;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:
(84 g·mol-1+100 g·mol-1)×ymol=9.20 g,解得y=0.05mol,当恰好完全反应时,由反应HCO3-+H+═CO2↑+H2O可知,消耗n(HCl)=0.100 mol,V(HCl)=![]() =0.5L。
=0.5L。
①当盐酸不足量,即a<0.5L时,按HCl量计算,V(CO2)=22.4 L·mol-1×n(HCl)=22.4 L·mol-1×0.2mol·L-1×aL=4.48a L;
②当盐酸足量,即a≥0.5L时,按HCO3-的量计算,V(CO2)=22.4 L·mol-1×0.0500mol×2=2.24 L;
故答案为:盐酸不足量时:a<0.5L,4.48a L;盐酸足量时:a≥0.5L,2.24 L。