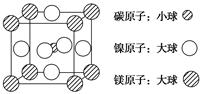
题目内容
经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。下列判断正确的是
| A.AlCl3为离子化合物 | B.SiCl4为共价化合物 |
| C.P 与Cl可形成离子键 | D.K与Mg 形成共价键 |
B
根据元素的电负性可知,铝元素和氯元素的电负性差小于1.7,所以氯化铝是共价化合物;同样氯元素和硅元素的电负性差小于1.7,形成的四氯化硅是共价化合物;氯元素与P元素的电负性也是形成小于1.7的,形成的化合物是共价化合物;K和Mg都是活泼的金属,二者不能形成共价键,选项B正确,其余都是不正确的,所以正确的答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ②
② 、③
、③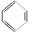 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。