题目内容
(10分)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
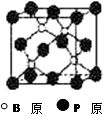
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式 。
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
。

回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式 。
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
。
(10分)(1)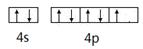 (1分)(2)B (1分)
(1分)(2)B (1分)
(3)原子晶体;sp3 , 4 (各1分,共3分)(4)> (1分)
(5)sp2,非极性 (各1分,共2分)
(6)磷原子的半径比氮原子大,N—P共价键键长比B—P小,键能大 (2分)
 (1分)(2)B (1分)
(1分)(2)B (1分)(3)原子晶体;sp3 , 4 (各1分,共3分)(4)> (1分)
(5)sp2,非极性 (各1分,共2分)
(6)磷原子的半径比氮原子大,N—P共价键键长比B—P小,键能大 (2分)
试题分析:(1)基态原子具有八种不同能量电子,说明核外有8个能级,所以是溴元素,其基态原子的价电子轨道表示式是
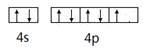 。
。(2)由于B原子的最外层电子数是3个,所以P原子提供孤对电子,B原子提供空轨道。
(3)由于BP属于耐磨涂料,所以形成的晶体应该是原子晶体。B原子形成4个共价键,所以每生成1molBP,共形成4molB-P键,其中B原子的杂化方式是sp3杂化。
(4)P元素被还原,说明P元素的非金属性强于B元素的,所以电负性是P元素的大。
(5)由于BBr3分子中,B原子没有孤对电子对数,所以是平面三角形结构,B原子采取sp2杂化杂化,键角为120°。
(6)由于二者形成的晶体都是原子晶体,而磷原子的半径比氮原子大,N—P共价键键长比B—P小,键能大,因此氮化硼晶体的熔点要比磷化硼晶体高。
点评:该题的关键是根据物质的性质准确判断出晶体类型,而在判断杂化类型时,需要首先判断分子的结构。

练习册系列答案
相关题目



 比
比 熔沸点高
熔沸点高