题目内容
3.水是自然界中普遍存在的一种物质,根据下列信息回答问题:(1)氧原子基态时价层电子的电子排布图为
 .
.(2)已知2H2O=H3O++OH-,H3O+的立体构型是三角锥形,中心原子的杂化类型是sp3.
(3)s轨道与s轨道重叠形成的共价键可用符号表示为:δs-s,p轨道与p轨道以“头碰头”方式重叠形成的共价键可用符号δp-p,则H2O分子含有的共价键用符号表示为δs-p.
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低,并说明理由.
稳定性:H2O>H2S>H2Se理由:非金属性越强,元素的氢化物越稳定.沸点:H2O>H2Se>H2S理由:H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高.
分析 (1)根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则进行书写;
(2)先计算其价层电子对,再确定中心原子的杂化方式和离子构型;
(3)根据H2O分子中氢原子的s轨道和氧原子的p轨道以头对头重叠;
(4)根据元素的非金属性越强,元素的氢化物越稳定;H2O分子之间存在氢键,沸点最高,H2Se与H2S大结构相似,相对分子质量越大,分子间作用力大,沸点越高.
解答 解:(1)由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布图为: ,价电子排布图为:
,价电子排布图为: ,故答案为:
,故答案为: ;
;
(2)H3O+中价层电子对$\frac{6+1×3-1}{2}$=4,氧原子采取sp3杂化,H3O+的分子立体结构为三角锥型,故答案为:三角锥形;sp3;
(3)H2O分子中氢原子的s轨道和氧原子的p轨道以头对头重叠,所以含有的共价键用符号表示为δs-p,故答案为:δs-p;
(3)非金属性越强,元素的氢化物越稳定,非金属性:O>S>Se,所以稳定性:H2O>H2S>H2Se;
H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高,所以沸点:H2O>H2Se>H2S,
故答案为:H2O>H2S>H2Se;非金属性越强,元素的氢化物越稳定;H2O>H2Se>H2S;H2O可形成分子间氢键,沸点最高,H2Se相对分子质量比H2S大,分子间作用力大,因而H2Se比H2S沸点高.
点评 本题主要考查价层电子对互斥理论、共价键的成键方式、氢键、同主族元素性质递变规律等,综合性较大,难度中等,是对知识的直接运用,需要学生具有扎实的基础.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.有8gNa2O2、Na2O、Na2CO3、NaOH的混合物与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得到的固体质量为( )
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法确定 |
14.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是 ( )
| A. | C的物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 容器内压强 | D. | 混合气体的平均分子量 |
13.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用托盘天平称量8.75g食盐 | |
| B. | 用500ml的容量瓶配制480ml溶液 | |
| C. | 用10ml量筒量取6.46ml盐酸 | |
| D. | 用广泛pH试纸测得某溶液的pH为4.5 |
 根据如图描述回答下列问题:
根据如图描述回答下列问题:
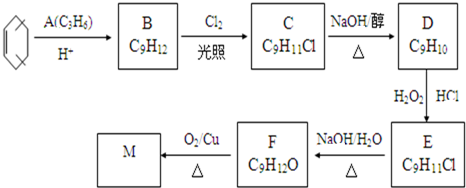
 ;
; ;
;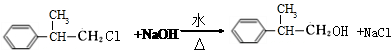 .
.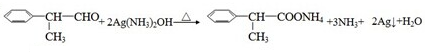 .
.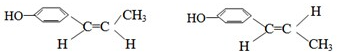 .
.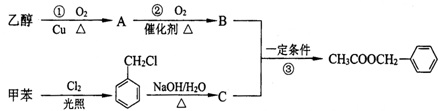
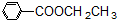 、
、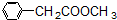 、
、
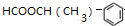 和
和 .
.