题目内容
下表是相同温度下三种酸的一些数据,下列判断正确的是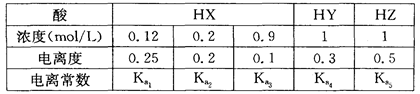
A.在相同温度下, > >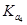 > >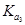 |
B.室温时,若在NaZ溶液中加水,则 / / · ·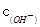 的比值变小,若加少量盐酸,则比值变大 的比值变小,若加少量盐酸,则比值变大 |
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则 < < < <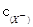 |
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且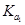 > >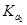 > >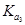 =0.01 =0.01 |
A
解析试题分析:电离度是弱电解质达到电离平衡时已经电离的电解质分子浓度占电解质分子总浓度的百分比。它不仅以温度有关,还与电解质的浓度有关。电离平衡常数是弱电解质达到电离平衡时电离产生的各种离子浓度的乘积与未电离的电解质分子的浓度的比。它只与温度有关,而与浓度无关。A. ;
; ;
;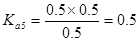 所以在相同温度下,
所以在相同温度下, >
>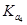 >
>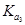 .正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O
.正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下,
HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下, >
>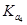 >
>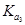 。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则
。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则 >
> >
>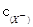 。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以
。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以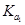 =
=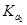 =
= 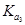 。错误。
。错误。
考点:考查电离度、电离平衡常数与浓度、温度的关系的知识。

已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
| A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4) |
| B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4) |
| C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-) |
| D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-) |
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
下列关于电解质溶液的叙述正确的是 ( )。
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
下列有关说法正确的是( )
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
常温下,将a mol/L的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
| A.若混合后溶液pH=7,则c(M+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) |
| C.若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
今有室温下四种溶液,有关叙述不正确的是( )
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(N
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)D.Va L ④与Vb L ②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9