题目内容
18.N2O4?2NO2平衡,减少N2O4的物质的量,平衡向左(填“向左”“向右”或“不”)移动,N2O4的转化率增大(填“增大”“减小”或“不变”,下同),N2O4的体积分数减小,NO2的体积分数增大.分析 发生反应N2O4?2NO2,减少N2O4的物质的量,瞬间NO2的浓度不变,N204的浓度减小,平衡向左移动,但由于减少N2O4的物质的量又等效于先成比例缩小体积,后再扩大到原来的体积,据此分析解答.
解答 解:发生反应N2O4?2NO2,减少N2O4的物质的量,瞬间NO2的浓度不变,N204的浓度减小,平衡向左移动,但减少N2O4的物质的量又等效于先成比例缩小体积再扩大,所以再扩大时,平衡向正反应方向移动,则N2O4的转化率增大,N2O4的体积分数减小,NO2的体积分数增大,
故答案为:向左;增大;减小;增大.
点评 本题考查化学平衡的移动,明确减小生成物的浓度对化学平衡的影响是解答本题的关键,注意“当减少N2O4的物质的量又等效于先成比例缩小体积再扩大”,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
8.下列气体中,无色无味的是( )
| A. | SO2 | B. | NO2 | C. | Cl2 | D. | CH4 |
9.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol?L-1、2.00mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
13.A,B,C,D四种短周期主族元素的原子序数依次减小,D在短周期主族元素中原子半径最大,C原子最外层电子数与电子层数相等,B元素的主要化合价:最高正价+最低负价=4,下列说法正确的是( )
| A. | C的氧化物是碱性氧化物 | |
| B. | D与A能形成原子个数比为1:1型的离子化合物 | |
| C. | 最高价氧化物对应水化物的酸性:B>A | |
| D. | 工业上电解由A,C两种元素组成的化合物制备C单质 |
5.某种氢氧燃料电池的电解质溶液为硫酸溶液,下列有关该电池的叙述不正确的是( )
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中硫酸的物质的量不变 | |
| C. | 电解质溶液中H+向正极移动 | |
| D. | 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.2 mol电子转移 |
12.下列有关同系物、同分异构体的说法正确的是( )
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请回答:
(1)编号元素中,化学性质最不活泼元素的原子结构示意图是Ne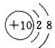 .
.
(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为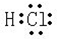 ,
,
(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为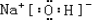 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为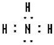 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).
(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
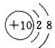 .
.(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为
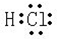 ,
,(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为
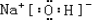 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为
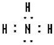 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
 将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示: