题目内容
17.利用废旧干电池拆解后的碳包滤渣(含MnO2、C、Hg2+等),既可制取MnSO4•4H2O,又可消除废弃物对环境的污染.实验流程如图一所示:
已知:25℃时,Ksp(FeS)=5×10-18,Ksp(MnS)=4.6×10-14,Ksp(HgS)=2×10-54.
(1)“浸取”时,生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O.
(2)滤渣Ⅰ的成分为MnO2、HgS和C(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中c(Hg2+)/c(Fe2+)=4×10-37(填数值).
(3)“氧化”时,溶液中Fe2+转化为Fe3+的离子方程式为2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O;滤渣Ⅱ的主要成分为Fe(OH)3(填化学式).
(4)最终MnSO4产率与“浸取”时m(FeS)/m(碳包滤渣)的投料比关系如图二所示,FeS用量超过最佳值时,MnSO4产率反而变小的原因是浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀.
分析 碳包滤渣(含MnO2、C、Hg2+等),加入FeS在70℃浸取发生反应:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,过滤滤渣Ⅰ的成分为MnO2、HgS和C,溶液中含有MnSO4、Fe2(SO4)3,加入MnO2继续氧化残留的Fe2+,发生反应2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,加入CaCO3,CaCO3与H+反应消耗H+,促使Fe3+水解平衡右移,调节溶液PH在PH=5,可使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,滤液溶质为MnSO4,浓缩结晶得到MnSO4•4H2O,
(1)根据题干信息反应物为MnO2、FeS、H2SO4,生成物为MnSO4、Fe2(SO4)3,结合氧化还原得失电子守恒和原子守恒分析解答;
(2)碳包滤渣(含MnO2、C、Hg2+等),根据所示实验流程图可知:滤渣Ⅰ的成分为MnO2、HgS和C,若浸取反应在25℃时进行,FeS足量,根据Ksp(FeS)、Ksp(HgS)计算充分浸取后溶液中c(Hg2+)/c(Fe2+);
(3)“氧化”时,溶液中Fe2+转化为Fe3+,MnO2转化为Mn2+,结合氧化还原得失电子守恒和原子守恒分析解答;结合水解平衡移动分析滤渣Ⅱ的主要成分为Fe(OH)3;
(4)浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀,所以FeS用量超过最佳值时,MnSO4产率反而变小.
解答 解:(1)MnO2和FeS在酸性条件下发生氧化还原反应,Mn(+4→+2),1molMnO2得到2mole-,Fe(+2→+3),S(-2→+6)1molFeS失去9mole-,最小公倍数为18,所以化学方程式为:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,
故答案为:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O;
(2)碳包滤渣(含MnO2、C、Hg2+等),加入FeS在70℃浸取发生反应:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,同时硫离子和汞离子结合生成HgS沉淀,碳和FeS、H2SO4不反应,所以滤渣Ⅰ的成分为MnO2、HgS和C,若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中S2-浓度相同,溶液中c(Hg2+)/c(Fe2+)=$\frac{{K}_{sp}(HgS)}{{K}_{sp}(FeS)}$=$\frac{2×1{0}^{-54}}{5×1{0}^{-18}}$=4×10-37,
故答案为:C;4×10-37;
(3)“氧化”时,溶液中Fe2+转化为Fe3+,MnO2转化为Mn2+,Mn(+4→+2),1molMnO2得到2mole-,Fe(+2→+3),最小公倍数为2,所以化学方程式为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,加入CaCO3,CaCO3与H+反应消耗H+,促使Fe3+水解平衡右移,调节溶液PH在PH=5,可使Fe3+完全沉淀,所以滤渣Ⅱ的主要成分为Fe(OH)3,
故答案为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O;Fe(OH)3;
(4)浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀,所以FeS用量超过最佳值时,MnSO4产率反而变小,
故答案为:浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀.
点评 本题考查了物质制备方案的设计流程分析判断,掌握离子的性质和调节溶液PH除去杂质离子是解题关键,注意沉淀溶解平衡原理的应用,题目难度中等.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |

(1)废钒催化剂需粉碎处理,目的是加快反应速率.
(2)填写并配平步骤②中的离子反应方程式.
6VO2++1C1O3-+6H2O=3V2O5↓+1Cl-+12H+;
(3)根据图二和下表信息,步骤②调节pH的合适范围是2.0~2.5.
| 开始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
(4)V2O5和NaOH溶液反应的化学方程式为V2O5+2NaOH=2NaVO3+H2O.
(5)步骤④中需加人硫酸,其原因是使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量.
(6)焙烧产生的气体用硫酸吸收后,其产物可以在该工艺中循环利用.
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,则放电时的负极产物为V3+.
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(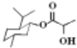 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
 .
. .
. $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O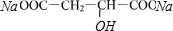 +2H2O+2CO2↑
+2H2O+2CO2↑ ,
, (或
(或 ).
). .
.