题目内容
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
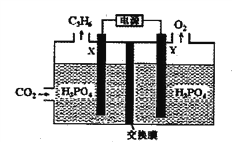
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
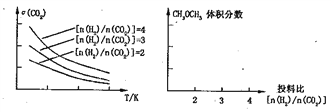
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
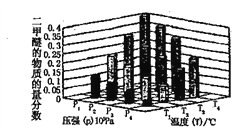
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
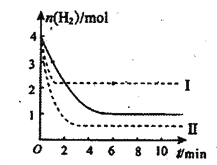
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
【答案】 3△H3-1/2△H1-9/2△H2 阳 H+ 3CO2+18e—+18H+==C3H6+6H2O ②
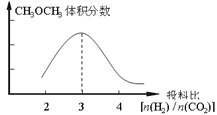 (大致方向正确既可以给分,但与3对应的必须是最高点) CD BC 增大压强(或增大CO2的浓度)
(大致方向正确既可以给分,但与3对应的必须是最高点) CD BC 增大压强(或增大CO2的浓度)
【解析】I(1) ①2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;②2H2O(g)=2H2(g)+O2(g) ΔH2;③H2O(g)==H2O(l) △H3。由③![]() ②
②![]() 可得,3CO2(g)+9H2(g)
可得,3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) 所以制取丙烯反应的△H= 3△H3-1/2△H1-9/2△H2。
C3H6(g)+6H2O(g) 所以制取丙烯反应的△H= 3△H3-1/2△H1-9/2△H2。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯。由图中信息可知,X为阴极、Y为阳极,阴极的电极反应为3CO2+18e—+18H+==C3H6+6H2O,阳极的电极反应为2H2O-4e-=4H++O2↑,反应过程中阴极要消耗氢离子,氢离子必须向阴极定向移动,所以交换膜为阳离子交换膜。
①电解池中的交换膜为阳离子交换膜,通过交换的离子是H+。
②阴极的电极反应为3CO2+18e—+18H+==C3H6+6H2O。
II.(3)将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。由图像可知,该反应的二氧化碳的转化率随温度升高而减小,所以该反应为放热反应。
CH3OCH3(g)+3H2O(g)。由图像可知,该反应的二氧化碳的转化率随温度升高而减小,所以该反应为放热反应。
①由化学方程式可知,在其他条件不变时,投料比n(H2)/n(CO2)=3时,平衡时CH3OCH3的体积分数最大,所以平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)变化的曲线图为 。
。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中。由题中信息及图像可知,温度越低、压强越大,则二甲醚的百分含量越高,所以T1>T2>T3>T4.、P1>P2>P3>P4,所以关于温度和压强的关系判断正确的是CD。
III用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-b kJ·mol—1(b>0),该反应为放热反应。
(4) A.该反应是气体分子数减少的反应,所以当气体的总压强不变,达到平衡状态;B. 从反应开始在反应到达平衡之前,CH3 OH(g)和H2O(g)的物质的量之比一直不变,所以CH3 OH(g)和H2O(g)的物质的量之比不变时,不一定是平衡状态;C.混合气体的密度一直不变,所以无法根据密度判断平衡状态;D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键,说明正反应速率和逆反应速率相等,达到平衡状态。总之,不能证明该反应达到化学平衡状态的是BC。
(5)由曲线Ⅱ可知,改变条件后,不仅化学反应速率加快了,而且平衡也向正反应方向移动了,所以对应的实验条件改变是增大压强(或增大CO2的浓度),不可能是升高温度(因为正反应为放热反应)。