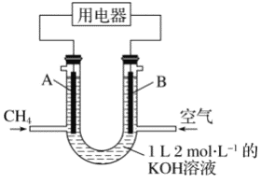
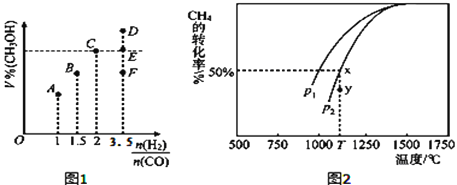
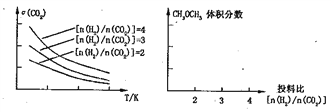
题目内容
【题目】下列说法正确的是
A.分子晶体中都存在共价键B.在单质的晶体中一定不存在阴离子
C.离子晶体中只有离子键D.干冰和冰中作用力完全相同
【答案】B
【解析】
A.分子晶体中不一定都存在共价键,例如稀有气体元素形成的分子中不存在化学键,A错误;
B.在单质的晶体中一定不存在阴离子,例如金属晶体中只存在阳离子和自由电子,B正确;
C.离子晶体中不一定只有离子键,例如氢氧化钠中存在离子键和共价键,C错误;
D.干冰和冰形成的均是分子晶体,其中作用力不完全相同,二者都存在分子间作用力,但冰中还有氢键,D错误;
答案选B。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
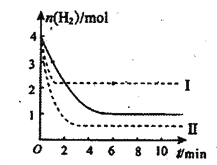
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
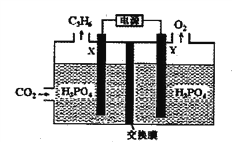
【题目】(题文)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃) Ag2SO4:0.796 g
(1)甲同学的实验如表:
序号 | 操作 | 现象 |
实验Ⅰ | 将2mL 1 molL-1 AgNO3溶液加入到1mL 1 molL-1 FeSO4溶液中 | 产生白色沉淀,随后又有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
注:经检验黑色固体为Ag。
①白色沉淀的化学式是__________________。
②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。
(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。
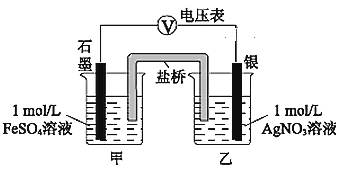
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;
②若该电池能维持稳定电流强度为1 A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”) ________g(已知F=96500 C·mol-1,电量(C)=电流(A)×时间(s) )。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
③a中甲烧杯里的电极反应式是______________。
④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。
(3)由上述实验得出的结论为_________________________________________________。