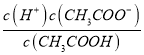��Ŀ����
����Ŀ������β���ж�������������Ϳ������������������Ҫ��ɣ�ij������������β��Ϊԭ��̽����������������Ļ�ѧ���ʣ�
��1��I������β�����������ࡢCO��SO2��NO�����ʣ���ұ���ķ���֮һ������������������װһ������ת���������ò����ٺϽ����������������ص���ʹCO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壬����ʹ������ȼ�ռ�SO2��ת����д��һ����̼��һ��������Ӧ�Ļ�ѧ����ʽ�� ������������ɫ������������̽��������Ⱦ��SO2�����ʣ������ͼʵ��װ�ã���ش�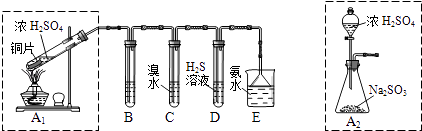
B��C��D�ֱ����ڼ���SO2��Ư���ԡ���ԭ�Ժ������ԣ���B����ʢ�Լ�Ϊ��C�з�Ӧ�����ӷ���ʽΪ ��
��2��Ϊ��ʵ����ɫ������Ŀ�꣬��ȡSO2װ�����ѡ�� �� ��A1��A2װ�ã��ð�ˮ����β���е�SO2 �� ������Һ���п��ܺ���OH����SO32����SO42����HSO3���������ӣ���ش�
��3����ˮ���չ���SO2�ķ�Ӧ�����ӷ���ʽΪ
��4����֪����������һ��������ˮ��SO2Ҳ������ˮ�������������Լ�Ϊ��С�ձ����Թܡ�����������ͷ�ιܡ�����װ�ú���ֽ��2mol/L���ᡢ2mol/LHNO3��1mol/LBaCl2��Һ��l mol/LBa��OH��2��Һ��Ʒ����Һ������ˮ�������ʵ��֤��������Һ���д���SO32����HSO3�� �� ����±���ʵ�������Ԥ������ͽ��ۣ�
ʵ����� | Ԥ����������� |
����1��ȡ����������Һ����С�ձ��У��ý�ͷ�ι�ȡl mol/L BaCl2��Һ��С�ձ��μ�ֱ�������� | �����ְ�ɫ���ǣ�����Һ�д���SO32���� SO42�� �� |
����2����С�ձ��е���Һ���ˡ�ϴ�ӣ���������ˮ�Ѹ�����ֽ�ϵĹ��������һС�ձ��У�����µĹ��� �� |
���𰸡�
��1��2CO+2NO?2CO2+N2��Ʒ����Һ��SO2+Br2+2H2O�TSO42��+2Br��+4H+
��2��A2
��3��NH3?H2O+SO2=NH4++HSO3��
��4������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ������Ʒ����ɫ���������ݣ������SO32���������ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3��
���������⣺��1��I��һ����̼��һ�������ڴ����������·�Ӧ���ɶ�����̼�͵���������ʽ��2CO+2NO2CO2+N2 �� ���Դ��ǣ�2CO+2NO2CO2+N2�� II������װ��ͼ��֪��ͭ��Ũ������ȷ�Ӧ���ɶ����������壬B��C��D�ֱ����ڼ���SO2��Ư���ԡ���ԭ�Ժ������ԣ�����C��D�ֱ�Ϊ��ˮ�������ˮ��Һ��C�����������Ļ�ԭ�ԣ�D�����������������ԣ������������Ư���Կ���ͨ��Ʒ����Һ��Ʒ����ɫ�Ƕ���������������ԣ�����������л�ԭ�ԣ��͵ⵥ�ʷ�Ӧ��������͵⻯�⣻��Ӧ�����ַ���ʽΪ��SO2+I2+2H2O�TSO42��+2I��+4H+��
���Դ��ǣ�Ʒ����Һ�� SO2+I2+2H2O�TSO42��+2I��+4H+����2��װ��ͼ������֪��A2����ȡװ��������A1װ�ã����Բ���Ҫ���Ȼ��Լ��Դ��ҩƷ���÷�Һ©������������Կ��Ʒ�Ӧ���ʣ����ڿ��Ʒ�Ӧ���У���Ӧ����֣�
���Դ��ǣ�A2����3����ˮ���չ���SO2�ķ�Ӧ�����ӷ���ʽΪNH3H2O+SO2�TNH4++HSO3����
���Դ��ǣ�NH3H2O+SO2�TNH4++HSO3������4������SO32����HSO3�����ӵ����ʺͼ��鷽�����ʵ����м�����ƣ���������Ϣ��������ȡ������С�ձ��м�������Ȼ�����Ӧ���ɳ���Ϊ�����ᱵ�����ᱵ������ȡ��������������ɶ�������ͨ�������������Ĵ��ڷ�����֤����������ӵĴ��ڣ�ȡ��Һ����������������Ӻ��ᷴӦ�������ɶ�������������������ʵ����ƣ���ͨ��������������Ӻ�����������Ӧ���ɳ��������жϣ�ʵ����Ʒ����Ͳ���Ϊ��
ʵ����� | Ԥ����������� |
����2������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�� | ��Ʒ����ɫ���������ݣ������SO32�� |
����3�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ���� | �����ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3�� |
�� ���Դ��ǣ�
ʵ����� | Ԥ����������� |
����2������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�� | ��Ʒ����ɫ���������ݣ������SO32�� |
����3�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ���� | �����ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3�� |

����Ŀ��1000mLij����Һ�г�����0.2molL��1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����Br����CO32����HCO3����SO32����SO42�� |
�ֽ�������ʵ������������Լ�����������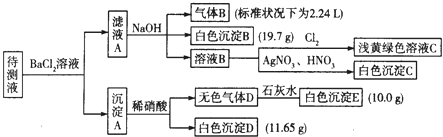
��1��д�����ɰ�ɫ����B�����ӷ���ʽ�� ��
��2������ɫ����D�ǵ�һ���壺 �ٽ������ӵ����ʵ���Ũ�������±��У�һ�������ڵ��0��������ȷ�������������
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/molL��1 |
���ж�ԭ��Һ��K+�Ƿ���ڣ������ڣ��������ʵ���Ũ�ȵ���Сֵ���������ڣ���˵�����ɣ� ��
��3������ɫ����D�ǻ�����壬����Һ��һ�����е��������� ��