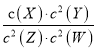��Ŀ����
����Ŀ��1000mLij����Һ�г�����0.2molL��1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����Br����CO32����HCO3����SO32����SO42�� |
�ֽ�������ʵ������������Լ�����������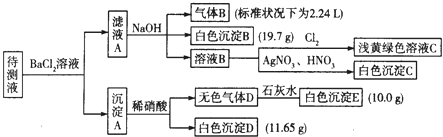
��1��д�����ɰ�ɫ����B�����ӷ���ʽ�� ��
��2������ɫ����D�ǵ�һ���壺 �ٽ������ӵ����ʵ���Ũ�������±��У�һ�������ڵ��0��������ȷ�������������
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/molL��1 |
���ж�ԭ��Һ��K+�Ƿ���ڣ������ڣ��������ʵ���Ũ�ȵ���Сֵ���������ڣ���˵�����ɣ� ��
��3������ɫ����D�ǻ�����壬����Һ��һ�����е��������� ��
���𰸡�
��1��HCO3��+Ba2++OH��=BaCO3��+H2O
��2�����ڣ�K+������СŨ��Ϊ0.1mol/L
��3��CO32����HCO3����SO32��
���������⣺����Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32����SO32����SO42�� �� ������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32�� �� ���ܴ���SO32����SO42���е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+�� ��ҺA����Ba2+ �� ���������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3�� �� һ��������Fe3+ �� ����BΪNH3 �� ��ɫ����BΪBaCO3 �� ��ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br�� �� ��ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl�� �� ���ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl������1��������������֪����ɫ����BΪ̼�ᱵ������HCO3����Ba2+��OH����Ӧ���ɣ���Ӧ���ӷ���ʽΪ��HCO3��+Ba2++OH��=BaCO3��+H2O��
�ʴ�Ϊ��HCO3��+Ba2++OH��=BaCO3��+H2O����2����������������֪������ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� ��
����ɫ����D�ǵ�һ���壬��DΪCO2 �� EΪCaCO3 �� ��Һ�к���CO32�� �� ��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ��û��SO32�� �� һ������SO42�� ��
B��̼�ᱵ�������ʵ���= ![]() =0.1mol����n��HCO3����=0.1mol����c��HCO3����=
=0.1mol����n��HCO3����=0.1mol����c��HCO3����= ![]() =0.1mol/L��
=0.1mol/L��
E��̼��ƣ������ʵ���= ![]() =0.1mol����n��CO32����=0.1mol����c��CO32����=
=0.1mol����n��CO32����=0.1mol����c��CO32����= ![]() =0.1mol/L��
=0.1mol/L��
D�����ᱵ�������ʵ���= ![]() =0.05mol����n��SO42����=0.05mol����c��SO42����=
=0.05mol����n��SO42����=0.05mol����c��SO42����= ![]() =0.05mol/L��
=0.05mol/L��
�ʴ�Ϊ��
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/molL��1 | �� | 0 | 0.1 | 0.1 | 0 | 0.05 |
��n��NH4+��=n��NH3��= ![]() =0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3����=0.1mol/L��c��CO32����=0.1mol/L��c��SO42����=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��=0.4mol/L��0.3mol��L=0.1mol/L��
=0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3����=0.1mol/L��c��CO32����=0.1mol/L��c��SO42����=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��=0.4mol/L��0.3mol��L=0.1mol/L��
�ʴ�Ϊ�����ڣ�K+������СŨ��Ϊ0.1mol/L����3����������������֪����Һ��һ������CO32����HCO3�� �� ����ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� ��
����ɫ����D�ǻ�����壬ֻ��ΪCO2��NO������壬��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ������SO32�� �� ����ȷ���Ƿ���SO42�� �� ����Һ��һ�����е���������CO32����HCO3����SO32�� ��
�ʴ�Ϊ��CO32����HCO3����SO32�� ��
��1������Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32����SO32����SO42�� �� ������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32�� �� ���ܴ���SO32����SO42���е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+��
��ҺA����Ba2+ �� ���������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3�� �� һ��������Fe3+ �� ����BΪNH3 �� ��ɫ����BΪBaCO3 �� ��ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br�� �� ��ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl�� �� ���ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl������2������ɫ����D�ǵ�һ���壬��DΪCO2 �� EΪCaCO3 �� ��Һ�к���CO32�� �� ��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ��û��SO32�� �� һ������SO42�� �� ����B��̼�ᱵ����E��̼��ƣ������ᱵ�����ʵ��������������غ��������ӵ�Ũ�ȣ�
���ݵ���غ��ж��Ƿ��м����ӣ�����Һ����K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ���㣻��3����Һ��һ������CO32����HCO3�� �� ����ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� �� ����ɫ����D�ǻ�����壬ֻ��ΪCO2��NO������壬��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ������SO32�� �� ����ȷ���Ƿ���SO42�� ��

����Ŀ������β���ж�������������Ϳ������������������Ҫ��ɣ�ij������������β��Ϊԭ��̽����������������Ļ�ѧ���ʣ�
��1��I������β�����������ࡢCO��SO2��NO�����ʣ���ұ���ķ���֮һ������������������װһ������ת���������ò����ٺϽ����������������ص���ʹCO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壬����ʹ������ȼ�ռ�SO2��ת����д��һ����̼��һ��������Ӧ�Ļ�ѧ����ʽ�� ������������ɫ������������̽��������Ⱦ��SO2�����ʣ������ͼʵ��װ�ã���ش�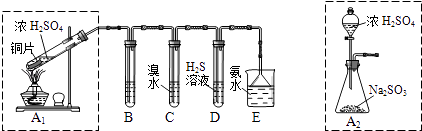
B��C��D�ֱ����ڼ���SO2��Ư���ԡ���ԭ�Ժ������ԣ���B����ʢ�Լ�Ϊ��C�з�Ӧ�����ӷ���ʽΪ ��
��2��Ϊ��ʵ����ɫ������Ŀ�꣬��ȡSO2װ�����ѡ�� �� ��A1��A2װ�ã��ð�ˮ����β���е�SO2 �� ������Һ���п��ܺ���OH����SO32����SO42����HSO3���������ӣ���ش�
��3����ˮ���չ���SO2�ķ�Ӧ�����ӷ���ʽΪ
��4����֪����������һ��������ˮ��SO2Ҳ������ˮ�������������Լ�Ϊ��С�ձ����Թܡ�����������ͷ�ιܡ�����װ�ú���ֽ��2mol/L���ᡢ2mol/LHNO3��1mol/LBaCl2��Һ��l mol/LBa��OH��2��Һ��Ʒ����Һ������ˮ�������ʵ��֤��������Һ���д���SO32����HSO3�� �� ����±���ʵ�������Ԥ������ͽ��ۣ�
ʵ����� | Ԥ����������� |
����1��ȡ����������Һ����С�ձ��У��ý�ͷ�ι�ȡl mol/L BaCl2��Һ��С�ձ��μ�ֱ�������� | �����ְ�ɫ���ǣ�����Һ�д���SO32���� SO42�� �� |
����2����С�ձ��е���Һ���ˡ�ϴ�ӣ���������ˮ�Ѹ�����ֽ�ϵĹ��������һС�ձ��У�����µĹ��� �� |
����Ŀ���±������ڱ��е�һ���֣�����A��I�����ڱ��е�λ�ã��ڣ�1������4��С����Ԫ�ط��Ż�ѧʽ�ش𣬣�5������8��С�ⰴ��ĿҪ��ش�
�� | I A | ��A | ��A | ��A | ��A | ��A | ��A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
��1������Ԫ�أ���ѧ��������õ��� �� ֻ�и��۶������۵��� �� ��������ǿ�ĵ����� �� ��ԭ����ǿ�ĵ����� ��
��2������������ˮ���������ǿ���� �� ������ǿ���� �� �����Ե��� ��
��3��A�ֱ���D��E��F��G��H�γɵĻ������У����ȶ��� ��
��4����B��C��E��F��G��H�У�ԭ�Ӱ뾶������ ��
��5��A��D����������ĵ���ʽ ��
��6��A��E��ɻ�����Ļ�ѧʽ ��
��7���õ���ʽ��ʾB��H��ɻ�������γɹ��̣� ��
��8��B������������ˮ�����C��������������Ӧ�����ӷ���ʽ�� ��