题目内容
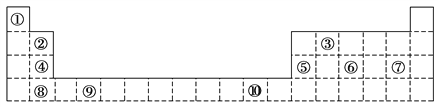
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其密度比水________。
(3)元素⑥原子的外围电子排布图为________;该元素与同主族相邻元素的氢化物的稳定性从大到小为________________ 。
(4)元素①的第一电离能________元素③(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
【答案】 Ti 苯 CCl4 大 3s23p3 NH3>PH3>AsH3 > < ![]() Be(OH)2+2NaOH===Na2BeO2+2H2O
Be(OH)2+2NaOH===Na2BeO2+2H2O
【解析】根据元素周期表中元素的分布,可知①是H,②是Be,③是C,④是Mg,⑤是Al,⑥是P,⑦是Cl,⑧是Ca,⑨是Ti,⑩是Cu。
(1)表中属于d区元素的是Ti,故答案为:Ti;
(2)表中元素H的6个原子与元素C的6个原子形成的某种环状分子名称为苯,C和Cl形成的一种常见溶剂的化学式为CCl4,其密度比水大;
故答案为:苯;CCl4;大;
(3)⑥是P元素,其原子的外围电子排布式为3s23p3,P元素相邻的同主族元素为N和As,同主族元素,从上往下,非金属性减弱,氢化物的稳定性减弱,故三者氢化物的稳定性由大到小的顺序为:NH3>PH3>AsH3;
故答案为:3s23p3;NH3>PH3>AsH3;
(4)①为H元素,③为C元素,C的外围电子排布为2p2,不是半充满也不是全充满结构,而H只有1个电子,排布为1s1,半充满结构,比较稳定,失去电子需要很大的能量,所以元素H的第一电离能大于元素C的第一电离能;⑥为P元素,⑦为Cl元素,处于同一周期,同一周期主族元素电负性逐渐增大,故⑥小于⑦;
故答案为:>;<;
(5)Cl和Ca形成氯化钙是离子化合物,电子式为:![]() ;
;
故答案为:![]() ;
;
(6)Al(OH)3与NaOH反应的方程式为:Al(OH)3+NaOH=NaAlO2+2H2O, ②为Be,与Al元素的性质具有相似性,则Be(OH)2+2NaOH=Na2BeO2+2H2O;
故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】除去下列物质中混有的少量杂质(括号内为杂质),所用试剂或方法错误的是
物质(杂质) | 除杂试剂或方法 | |
A | CO2(SO2) | NaOH溶液 |
B | 汽油(H2O) | 分液 |
C | FeCl3溶液(FeCl2) | Cl2 |
D | Na2CO3固体(NaHCO3) | 加热 |
A. A B. B C. C D. D
【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答: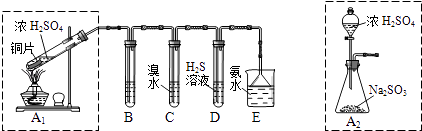
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |