题目内容
【题目】在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. 与Mg反应的起始速率
C. OH-的物质的量浓度 D. 溶液中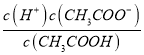
【答案】C
【解析】A.中和时所需NaOH的量与醋酸的物质的量成正比,n(CH3COOH)=0.01mol/L×0.1L=0.1mol/L×0.01L=0.001mol,两种酸的物质的量相等,则消耗的NaOH相等,故A错误;B.反应速率与氢离子浓度成正比,前者醋酸溶液中c(H+)前者小于后者,所以开始与镁反应速率:前者小于后者,故B错误;C.醋酸溶液中c(OH-)与溶液中c(H+)成反比,溶液中c(H+)前者小于后者,所以c(OH-)前者大于后者,故C正确;D.溶液中 =Ka,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故D错误;故选C。
=Ka,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故D错误;故选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答: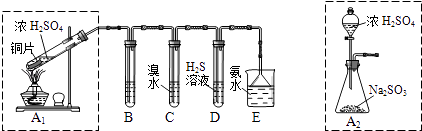
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |